- 角膜上皮の再生医療―体細胞からiPS細胞へ
大阪大学ヒューマン・メタバース疾患研究拠点(WPI-PRIMe) 西田 幸二
(寄稿日:2023年3月) - 脊髄損傷の再生医療
慶應義塾大学 医学部生理学教室 岡野 栄之(寄稿日:2020年1月) - 網膜再生医療の現状と未来
理化学研究所 生命機能科学研究センター
網膜再生医療研究開発プロジェクト
高橋 政代
(寄稿日:2019年3月) - 神経疾患に対する再生医療
京都大学 iPS細胞研究所 高橋 淳(寄稿日:2019年3月) - 心臓の再生医療
大阪大学 心臓血管外科 澤 芳樹(寄稿日:2019年3月)
心臓の再生医療
大阪大学 心臓血管外科 澤 芳樹
寄稿日(2019年3月)
- 1.iPS細胞による心筋再生治療
-
2007年11月、山中伸弥教授らがヒトiPS細胞の樹立に成功したニュースは世界中を駆け巡り、再生医療実現化に対する期待は大いに高まっている。実際に、ヒトiPS細胞の樹立が報道され、山中教授らが報告した雑誌「Cell」のオンラインサイトで閲覧できる、iPS細胞から作製された心筋細胞が拍動している動画を見たときの衝撃は記憶に新しい。さらに山中教授は2012年10月にノーベル生理学医学賞を受賞された。この快挙は、これまでの生命科学のメカニズムを説き明かす大変大きな発見であるとともに、これまで治療法が無かった難病の患者さんにも光が届く可能性が大いに期待され、発見から8年でのノーベル賞受賞となった。さらに、2014年には神戸理研の高橋政代プロジェクトリーダーは、世界初のiPS細胞を用いた網膜再生の臨床試験に成功し、さらに2017年にはCiRA由来の他家iPS細胞を用いた臨床試験も開始した。このようにiPS細胞の安全性検証等のもと各臓器への治療応用がいよいよ始まった。
心臓再生治療開発において、前述のシート化する細胞源として筋芽細胞では、Responderは限られてくるし、その治療効果のメカニズムは、あくまでも筋芽細胞から分泌される成長因子等の影響が大きく、自己の組織修復能を賦活化し、心機能が改善させることにあり、失われた心筋組織を本格的に修復・再生するためには、やはり心筋細胞を補充することが必要で、iPS細胞由来の心筋細胞による再生治療こそ“真”の心筋再生治療と呼べるのではないかと考える。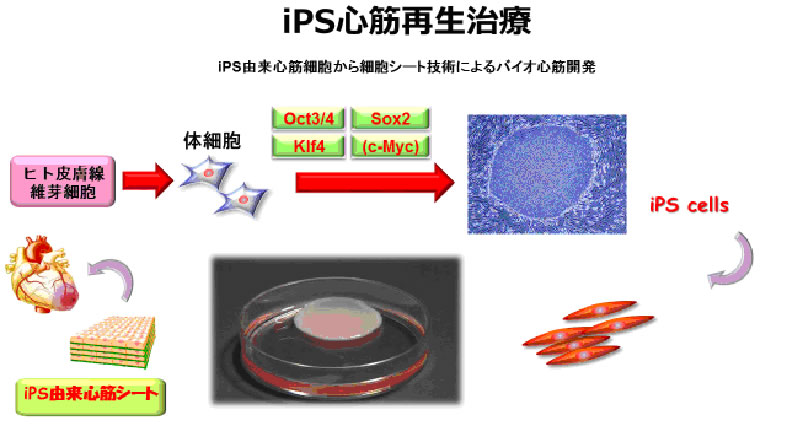
- 2.iPS細胞由来心筋細胞シートの非臨床研究
著明な線維化を呈し、心筋細胞を多量に失った高度心不全に対しては、失った健常な心筋細胞を補うことが必要であり、心筋細胞移植が、心筋細胞の枯渇した梗塞巣に、健常な心筋細胞を補填する治療になりえるものと思われる。近年、体細胞よりiPS細胞が誘導され、様々な細胞に分化することが報告されたが、同細胞より心筋細胞に生理的、解剖学的に相同性の高い、心筋細胞を誘導することが可能となっている 1)。
同心筋細胞を用いて、心筋細胞シートを作成することが可能であり、大動物心不全モデルを用いた同組織のProof of Conceptも得られている 2,3)。また、移植したiPS細胞由来心筋細胞シートはレシピエント心内で、収縮弛緩を繰り返し、作業心筋として機能する可能性があることが示されると同時に、iPS細胞由来心筋細胞シートは、レシピエント心と同期して挙動しており、同組織の拍動がレシピエント心に対して直接作用する可能性があることが示されている。また、iPS細胞由来心筋細胞シートは作業組織として機能するだけではなく、同組織から肝細胞増殖因子をはじめとしたサイトカインが分泌され、移植した臓器に血管新生を起こさせ、血流の改善がおこることも示されている。
また、iPS細胞に発現しているN-glycan等の補体の発現パターンは、心筋細胞への分化過程において、成熟心筋細胞と類似した発現パターンになってきていることが示されており、iPS細胞由来心筋細胞の免疫原性を検証する上で重要であるものと思われる。また、HLAホモiPS細胞由来心筋細胞は、カニクイサルの同種移植実験において、免疫原性を抑制することが知られており、臨床応用の際にはCiRAが構築しているHLAホモiPS細胞をHLAマッチングした患者に移植することが免疫学的に有効であることが予想される。今後、移植iPS細胞由来心筋細胞の生着効率を促進させることにより、より有効性を向上させることが可能であると思われる。in vivoでの生着効率の向上には、iPS細胞の免疫原性の抑制、移植組織に対する栄養血管の構築が必要である。免疫原性の抑制に関しては、iPS細胞由来心筋細胞を移植した際の免疫反応のメカニズムの解明等の基礎的研究が必須であるものと思われる。また、組織を維持しうる栄養血管の構築に関しては、新生血管は血管内皮細胞を裏打ちする平滑筋細胞を有するような機能的血管が必要であり、豊富な血管網を有する大網とiPS細胞由来心筋細胞シートを同時移植することにより、心筋細胞の生着が維持されることが非臨床研究で解明されている。
本細胞の心不全への応用においては、安全性の検討、細胞の大量培養法の開発が重要である。大量培養法に関しては、すでに基本技術は開発されており 4)、臨床応用化を進めている。また同時に同細胞の安全性の検証を十分に行うことが重要であり、すでに、未分化細胞のマーカー、およびNOGマウスを用いた造腫瘍性に関わる安全性の検証システムが確立されている。そしてiPS細胞臨床株を用いて、本来の造腫瘍性に関する安全性だけではなく、分化誘導後に癌化を促す遺伝子異常が発生していないかの検証も行ってきた。これらのレギュラトリ-サイエンスを構築し、安全性確保のデーターに基づく臨床研究のプロトコールを申請し、第一種特定認定委員会及び厚労省再生医療評価部会での承認が得られた。今後最終に人に投与するiPS細胞臨床株からの十分な料の心筋細胞の大量培養とその造腫瘍性や遺伝子変異などの安全性が検証されれば、いよいよ心不全患者への臨床応用が行われる。
- 文献
-
- Yu T, Miyagawa S, Miki K, et al. In Vivo Differentiation of Induced Pluripotent Stem Cell-Derived Cardiomyocytes. Circ J.
- Kawamura M, Miyagawa S, Miki K, et al. Feasibility, safety, and therapeutic efficacy of human induced pluripotent stem cell-derived cardiomyocyte sheets in a porcine ischemic cardiomyopathy model. Circulation;126:S29-37.
- Kawamura M, Miyagawa S, Fukushima S, et al. Enhanced survival of transplanted human induced pluripotent stem cell-derived cardiomyocytes by the combination of cell sheets with the pedicled omental flap technique in a porcine heart. Circulation;128:S87-94.
- Matsuura K, Kodama F, Sugiyama K, et al. Elimination of remaining undifferentiated induced pluripotent stem cells in the process of human cardiac cell sheet fabrication using a methionine-free culture condition. Tissue Eng Part C Methods 2015;21:330-338.
神経疾患に対する再生医療
京都大学 iPS細胞研究所 高橋 淳
寄稿日(2019年3月)
-
プラナリアなど、いわゆる下等生物でみられるように、本来の、あるいは狭い意味での「再生」とは自己修復である。すなわち、失われた組織を自分の内在性幹細胞によって修復する。ヒトにおいても擦り傷が自然に治るように僅かな自己修復能力は残っているが、基本的には失われた組織は元には戻らない。特に中枢神経系は再生能力が低く、外傷や変性疾患で失われた神経細胞は再生されない。多くの脳卒中や外傷の患者さんが後遺症に悩んでおられることがその事実を物語っている。
現在、再生医療といえば、細胞移植による組織再生を指す場合が多い。作用機序としては大きく二つに分けられる。一つは、移植細胞から分泌されるサイトカインによって細胞死を抑制する、あるいは内在性の再生を促進するというもの。間葉系幹細胞を用いた細胞移植が主で、移植細胞は数ヶ月で消滅する。これは現在広く行われている薬物治療と同様の戦略であり、将来的には移植細胞が分泌するサイトカインあるいはエクソソームの同定に繋がり、細胞は使われなくなるであろう。
もう一つは、移植細胞がその組織の細胞として生着し機能するというもので、ES/iPS細胞を用いた細胞移植に多くみられる。特に神経疾患においては、神経回路が繋がっているということが重要なので、細胞移植による神経回路再構築を目指すことになる。そのためにES/iPS細胞からその組織に必要な神経細胞を誘導し、移植し、軸索伸展を促す。
対象疾患としては、脳梗塞、頭部外傷、脊髄損傷やパーキンソン病などの神経変性疾患がある。他に、網膜や蝸牛など感覚器の神経変性も対象となる。上で述べたどちらかの機序、あるいは両方を期待した細胞移植が試みられている。ES/iPS細胞を用いた臨床試験は特に加齢黄斑変性(網膜の外側にある網膜色素上皮細胞が変性脱落する疾患)において進んでおり、2011年に世界で初めてヒトES細胞を用いた細胞移植が行われ、良好な結果が報告されている 1)。ヒトiPS細胞を用いた世界初の臨床試験は、同じく加齢黄斑変性に対して2014年に日本で行われた 2)。我々はパーキンソン病に対するiPS細胞を用いた細胞移植治療を目指しており、以下に、一つのケーススタディーとして紹介する。
パーキンソン病は中脳黒質から線条体に投射するドパミン神経細胞が進行性に脱落する神経変性疾患で、主に振戦、筋強剛、無動などの運動機能障害を呈する。失われたドパミン神経細胞を補う目的で1987年に胎児の中脳黒質細胞移植が行われて以来約400例の移植が行われてその有効性が証明されており、近年では約20年にわたって症状改善や細胞生着がみられた症例も報告されている 3)。しかし、胎児組織の利用には倫理的課題があり、かつ十分な量の細胞を得るのが難しい。そこでES/iPS細胞の利用に期待が寄せられている。
ES/iPS細胞はあらゆる臓器の細胞に分化することができる。ここでは詳細を省くが、移植のためのドパミン神経細胞を誘導するには、受精卵から神経系組織、中脳腹側に存在するドパミン神経細胞へと分化する発生過程を培養皿の中で再現する。さらに我々は、増殖の危険性のある未分化細胞を取り除き、ドパミン神経細胞を濃縮する目的でセルソーティングという技術を取り入れた 4)。こうして細胞製造方法を確立したのち、臨床応用のシミュレーションとして、カニクイザルモデルを用いた移植実験をおこなった 5)。この実験では合計約500万個のヒトiPS細胞由来ドパミン神経細胞を8頭の両側線条体に移植し、最大2年間の経過観察を行った。スコア評価とビデオ記録による自動運動量定量化によって神経症状を解析したところ、有意な症状改善と運動量増加が確認できた。脳切片の組織学的解析では片側あたり約64,000個(両側では128,000個)のドパミン神経細胞生着が明らかとなり、悪性所見は認められなかった。
臨床試験では京都大学iPS細胞研究所で作製された臨床用細胞株を使用する。この細胞は日本人に最も多いHLA型をホモ接合体として有し、HLAを合わせることによって移植後の免疫反応の軽減が期待される。我々は、この臨床用細胞株を用いて、iPS細胞由来ドパミン神経細胞の安全性と有効性を念入りに検証し、医師主導治験に臨んだ。治験の目的は「ヒトiPS細胞由来ドパミン神経前駆細胞のパーキンソン病患者被殻への移植における安全性および有効性の評価」である。京都大学医学部附属病院で7例の患者に細胞移植を行い、移植後2年間経過観察する。薬物療法での症状コントロールが難しくなった中程度のパーキンソン病患者が対象となる。全身麻酔下に両側穿頭術を行い、左右の被殻にそれぞれ約240万個の細胞を定位的脳手術の手法で移植する。我々は2018年10月に第1例目の移植手術を行った。
このように、再生医療の実現には基礎研究に基づいた科学的根拠が重要であり、臨床用細胞株を用いての安全性・有効性確認が必須である。さらに基礎研究と臨床応用実現の間に横たわる「死の谷」を超えるためには、様々な方面との連携が必要となる。まずは、最終的な再生医療等製品を製造販売する企業。また、再生医療等製品を審査承認する規制当局。いわゆる産官学連携を、開発早期から最終製品を想定しながら進める必要がある。さらには臨床応用の現場となる診療科や病院の臨床試験部門。忘れてならないのが、患者さん。臨床医学の基本は「患者さんから学ぶ」ということであり、臨床試験開始はゴールではなく新たなステージの始まりである。動物実験では限界があり、臨床にいって初めて分かることが多く存在する。臨床応用で抽出された課題をもう一度基礎研究で検討する、いわゆるリバース・トランスレーションを繰り返すことによって理想的な治療法の開発が可能となる。
以上、パーキンソン病を例に取り神経疾患に対する再生医療を紹介した。基本的な部分は神経疾患であれ他の疾患であれ共通である。多くの方々が力を合わせて、再生医療を理解しより良くする社会を築くことを期待します。
- 文献
-
- Schwartz SD, Regillo CD, Lam BL, Eliott D, Rosenfeld PJ, Gregori NZ, Hubschman JP, Davis JL, Heilwell G, Spirn M, Maguire J, Gay R, Bateman J, Ostrick RM, Morris D, Vincent M, Anglade E, Del Priore LV, Lanza R: Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. Lancet 385: 509-516, 2015.
- Mandai M, Watanabe A, Kurimoto Y, Hirami Y, Morinaga C, Daimon T, Fujihara M, Akimaru H, Sakai N, Shibata Y, Terada M, Nomiya Y, Tanishima S, Nakamura M, Kamao H, Sugita S, Onishi A, Ito T, Fujita K, Kawamata S, Go MJ, Shinohara C, Hata KI, Sawada M, Yamamoto M, Ohta S, Ohara Y, Yoshida K, Kuwahara J, Kitano Y, Amano N, Umekage M, Kitaoka F, Tanaka A, Okada C, Takasu N, Ogawa S, Yamanaka S, Takahashi M: Autologous induced stem-cell-derived retinal cells for macular degeneration. N Engl J Med 376: 1038-1046, 2017.
- Barker RA, Drouin-Ouellet J, Parmar M: Cell-based therapies for Parkinson disease—past insights and future potential. Nat Rev Neurol. 11: 492-503, 2015.
- Doi D, Samata B, Katsukawa M, Kikuchi T, Morizane A, Ono Y, Sekiguchi K, Nakagawa M, Parmar M, Takahashi J: Isolation of Human Induced Pluripotent Stem Cell-derived Dopaminergic Progenitors by Cell Sorting for Successful Transplantation. Stem Cell Rep. 2: 337-350, 2014.
- Kikuchi T, Morizane A, Doi D, Magotani H, Onoe H, Hayashi T, Mizuma H, Takara S, Takahashi R, Inoue H, Morita S, Yamamoto M, Okita K, Nakagawa M, Parmar M, Takahashi J: Human iPS cell-derived dopaminergic neurons function in a primate Parkinson’s disease model. Nature 548: 592-96, 2017.
網膜再生医療の現状と未来
理化学研究所 生命機能科学研究センター
網膜再生医療研究開発プロジェクト
高橋 政代
寄稿日(2019年3月)
-
再生医療(細胞治療)には障害された細胞を置き換える治療と、移植細胞の分泌する栄養因子による効果を狙う治療とに分けられる。現在世界中で行なわれている細胞治療は後者が多いが、眼科領域では主に細胞を置き換える治療が根治治療として研究開発されている。
眼科領域では角膜の再生医療と網膜の再生医療がある。角膜の再生医療は2000年代にすでに角膜上皮幹細胞や口腔粘膜細胞を用いたreplcaement therapyがなされ、臨床研究の報告がされた 1)。一方、網膜再生医療研究は20年前に普通の眼科医が神経幹細胞という違分野の新しい概念に出会ったところから始まった 2)。神経幹細胞からES細胞研究と進み、その後にiPS細胞の発明という細胞生物学の概念を変える発見があり、2013年にはそのiPS細胞を使用した初めての臨床応用である自家iPS細胞由来網膜色素上皮(RPE)細胞移植の臨床研究が始まった。網膜色素上皮の老化によって起こる加齢黄斑変性を若返った正常な組織で置き換えることは根本治療につながると考える。(図1)
網膜では光は視細胞に受け取られ神経シグナルに変換されて2次ニューロン、3次ニューロンと伝達され、3次ニューロンの軸索が視神経となって脳に繋がる。視細胞とそれを維持するために必要なRPEは網膜の外層をなし、この2種類の細胞が障害される疾患が視覚障害の多くの割合を占める。その代表格がRPEの老化により引き起こされる加齢黄斑変性と視細胞の遺伝子変異で起こる網膜色素変性である。
2014年9月に移植された自家iPS細胞由来RPE細胞シート 3) は手術後4年が経過したが、拒絶反応はなく細胞シートの色調も変わらず生着している。全身的にも腫瘍は発生していない。視力は予測どおり矯正視力で0.1を保っている。当初の病態沈静化の効果は主に併用して行った脈絡膜新生血管抜去術の効果と考えられたが、4年の経過の後も無治療で再発なく、移植細胞シート上の視細胞とシート下の脈絡膜血管層厚が維持できていることはiPS細胞由来RPEシートによる効果であり、移植細胞が機能していると判定できる。常に細胞レベルの微細構造を外来で観察しており構造が機能に直結している眼科領域ではReplacement therapyの効果は統計学的有意差ではなく構造の再構築によって示されると考える。
自家RPE細胞は科学的には最もよい治療材料であるものの、作成コストが莫大でありシートは手術法の難易度が高いという問題がある。これは当初から予測されたことで、広く使える治療とするためには、他家移植が必要である。しかし、加齢黄斑変性の患者は70歳以上が大部分と占めている上に患者数も多い中、外来で眼科医が全身的免疫抑制剤でコントロールすることは現実的でない。そこで京都大学で作成されたHLA6座ホモのiPS細胞ストックを用いてHLAがマッチした患者への他家移植が適していると考え、そのためサルでの拒絶反応の確認や他家移植のプロトコールなどの準備を慎重に進めた。他家移植では研究所のGMP準拠CPCでも細胞は前もって数十人分を作って冷凍保存することができるためコストも時間も削減できる。実際、2017年3月に他家iPS細胞を用いた1例目の手術が行われ速やかに9月までに計画の5例の手術が終了した。(図2)
我々が1例目の手術を行った頃、iPS細胞は遺伝子を導入し無限に増殖する細胞なので世界的に臨床応用は危険であると思い込まれていた。よって、これまでは自家、他家のiPS由来分化細胞の免疫拒絶を含めた安全性を示すのが主眼の臨床研究であったが、次は効果を探りシステムを作る真の治療作りのための臨床研究、治験へと続く。
また、重度の加齢黄斑変性や網膜変性疾患における視細胞の変性に対しては視細胞のreplacementが必要であるが、iPS細胞由来の立体網膜シートをマウスモデルに移植して多角的に検討し、動物でのproof of concept (POC)が得られた 4)。(図3)世界的には視細胞の懸濁液の移植が研究の主流であったが、過去の移植視細胞生着や機能回復の報告は移植細胞の細胞質が宿主視細胞に取り込まれたことによる効果で移植細胞は生着していなかったことが明らかとなったため、現在は我々のシート移植のみが確かな機能回復の証拠を示している状態である。網膜組織の移植であることに大きな利点があると考えている。そして重度の状態では視細胞とRPEとセットのシートで移植することが望ましい。
細胞治療は全く新しい分野であるため既存のルールがそぐわない。これまでの創薬では長い期間の治験を経て治療が可能となるが、その間の細胞作成法や治療法の改善がやや困難で再生医療のように進歩が早い分野では、ともすると多大な費用と時間を費やした後にとっくに遅れた方法の治療がでてくるということになる。日本では臨床応用への道として臨床研究と治験の二つのトラックがあるために、これまで世界でも珍しく臨床医が深く関わって臨床研究で進めてきたプロジェクトが100以上存在する。臨床医が密接に関わって開発する臨床研究の形は数年毎に改変が必要な再生医療には適していると考える。実際、再生医療のための二つの法律は省庁と再生医療学会が協調して作った法律とも言える。そして、我々は臨床研究というトラックを使ったことによって、少ない症例からの経験を生かしリバーストランスレーショナルリサーチをするというサイクルを2サイクルすでに回して改善し前進していることになる。(図4)
日本では再生医療に対する新しい法体系ができ世界を牽引しているが、このシステムは産官学の連携によりもたらされる新しい治療開発スキームで従来の治療開発の問題点を解決する可能性があると感じている。また今後は低分子化合物などの創薬にも適応されていく。安全性に関しても、細胞そのものの安全性だけではなく、体内で個々の患者の状態によって変化するという特性から治療としてのリスクを考える必要がある。よって、これまでの創薬の治療開発スキームとは異なるシステムを構築する必要があると考える。
さらに基礎研究の分野では、細胞という常に変化しヘテロな集団を材料とするため実験に匠の技を必要とするという問題点がある。ここで生物学とAI、工学との新たな融合がさらなる進展を見せるに違いない。
- 文献
-
- Nishida K et al. N Engl J Med 2004; 351:1187-1196
- Takahashi M et al. Molecul Cell Neurosci, 1998; 12:340-348
- Mandai et al. New Eng J Med, 2017; 376:1038-1046
- Mandai et al. Stem Cell Reports 2017; 1:69-83
-
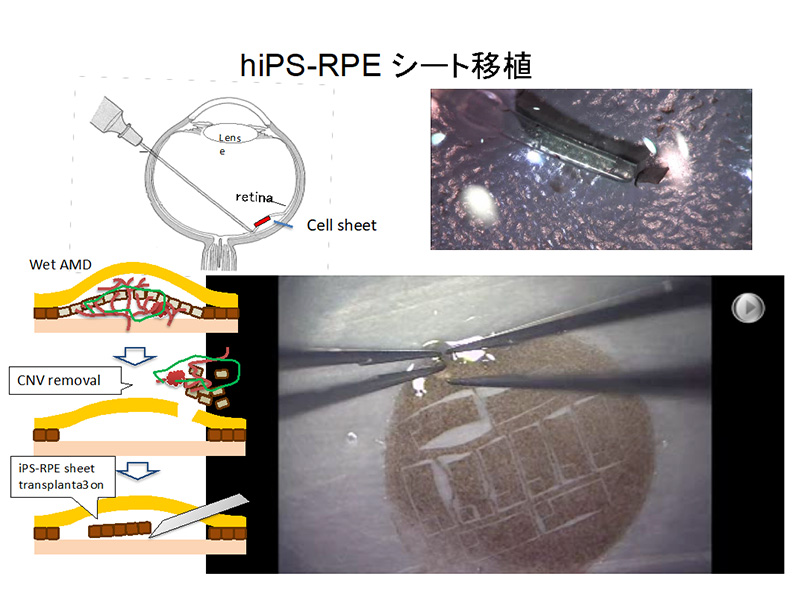
図1
-
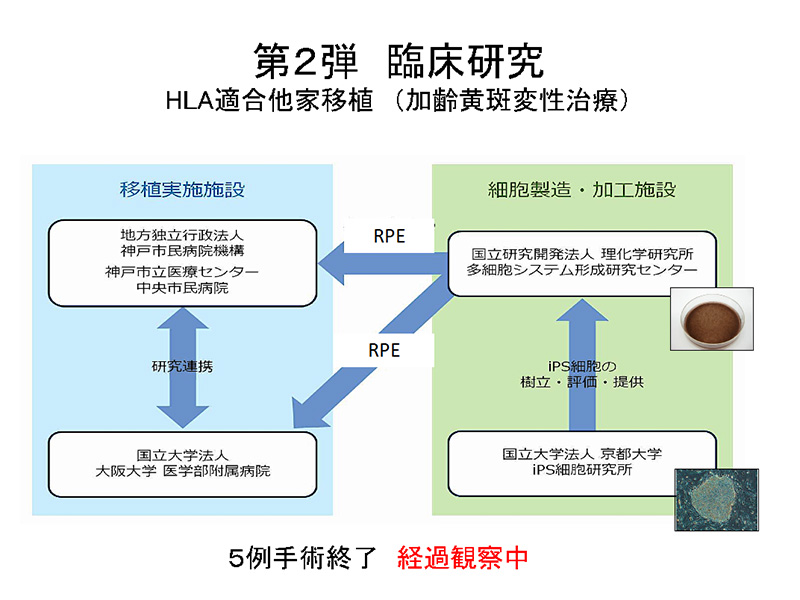
図2
-
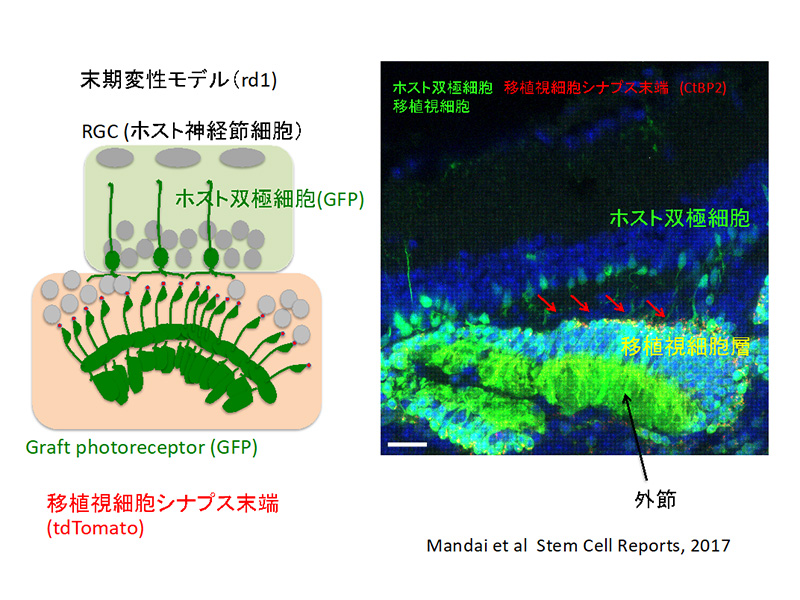
図3 ホスト2次ニューロンと移植視細胞シナプス形成
Mandai et al Stem Cell Reports, 2017より改変
-
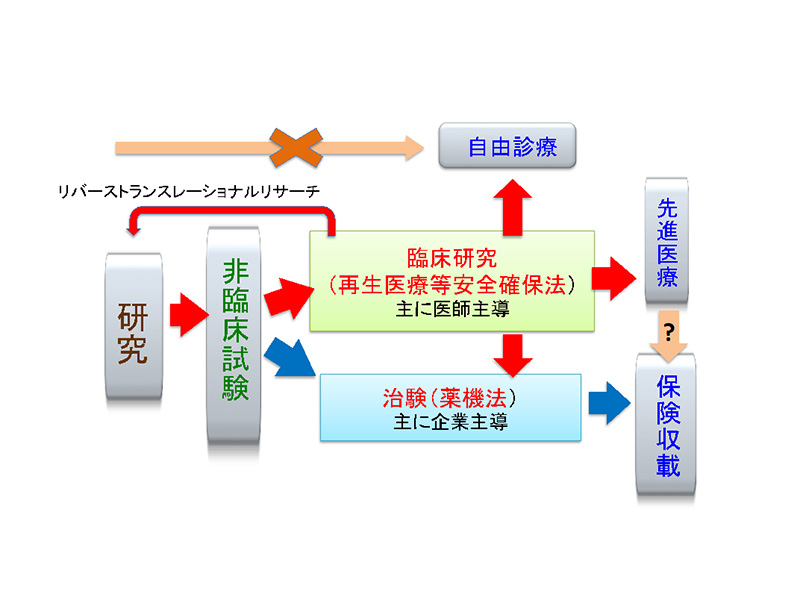
図4 再生医療に関する日本の法体制
脊髄損傷の再生医療
慶應義塾大学 医学部生理学教室
岡野 栄之
寄稿日(2020年1月)
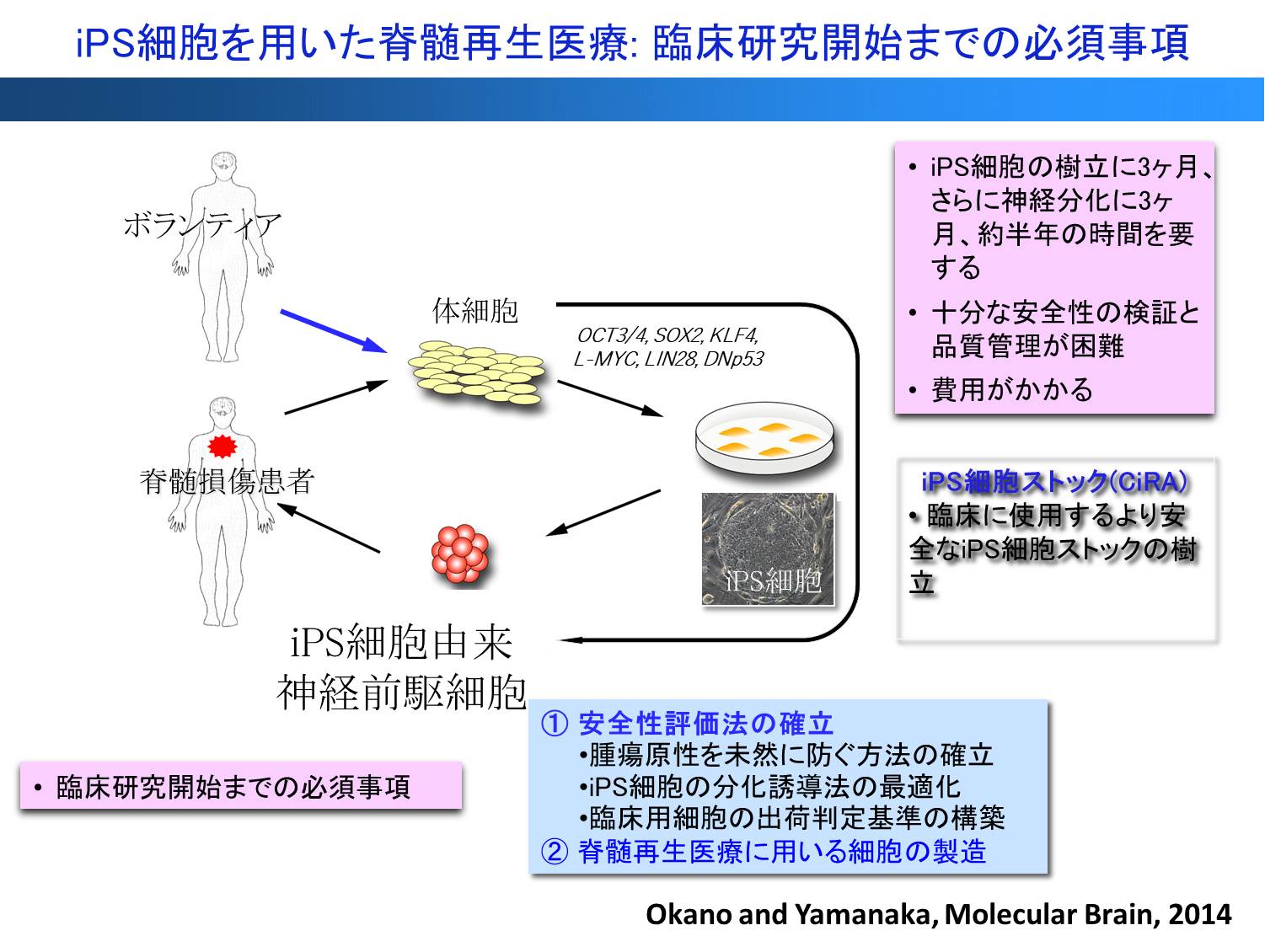
成体ほ乳類の中枢神経は一度損傷を受けると再生しないと信じられてきた。過去の多くの研究にもかかわらず、いまだ脊髄損傷患者に対する有効な治療法はないのが実状である。そのため、幹細胞を用いた脊髄再生医療の実現が切望されてきた。私たちと慶應義塾大学医学部整形外科の中村雅也 先生教授の共同研究グループは、20年以上に渡り幹細胞システムを用いた脊髄損傷の再生の研究を行ってきた。同研究を開始したころ私は、大阪大学医学部の神経解剖学部門を担当していたが、1998年にRNA結合性蛋白質であるMusashi1という私たちが見出した神経幹細胞マーカーを指標に成人脳に神経幹細胞が存在することを見出し1)、2000年にはFACSでこれら成人脳の神経幹細胞を分離する技術を開発し2)、成人の中枢神経系の可能性を示す成果を発表してきた。これをきっかけに、脊髄再生を含む中枢神経系の再生医療を目指すトランスレーショナル・リサーチを始めるに至り、大阪大学在籍中に、ラット脊髄損傷モデルへ神経幹細胞移植による脊髄再生研究を開始するに至った。2001年、慶應義塾大学生理学教室に着任以来、脊髄再生を目指して整形外科学教室との共同研究体制を構築した。また、げっ歯類と人の違いを意識し、霊長類モデルによる実験系確立を目指し、実験動物研究所との共同研究を開始し、マーモセット脊髄損傷モデルを開発し、ヒト胎児由来の神経幹細胞移植を行い、運動機能の回復に成功した3)。 しかし、胎児由来を用いることの倫理的な問題により、2006年に制定された厚労省の指針により、当時開発を進めていた胎児由来神経幹細胞は、実際の臨床研究に使えない状況になり、窮地に陥ることもあった。また、臨床応用を見据えた研究を行う一方で、脊髄損傷の病態を含む様々な基礎研究を行い、その成果は、現在の新しい脊髄再生の治療法に結びついている4-6)。
- iPS細胞を用いた脊髄損傷の再生医療の開発
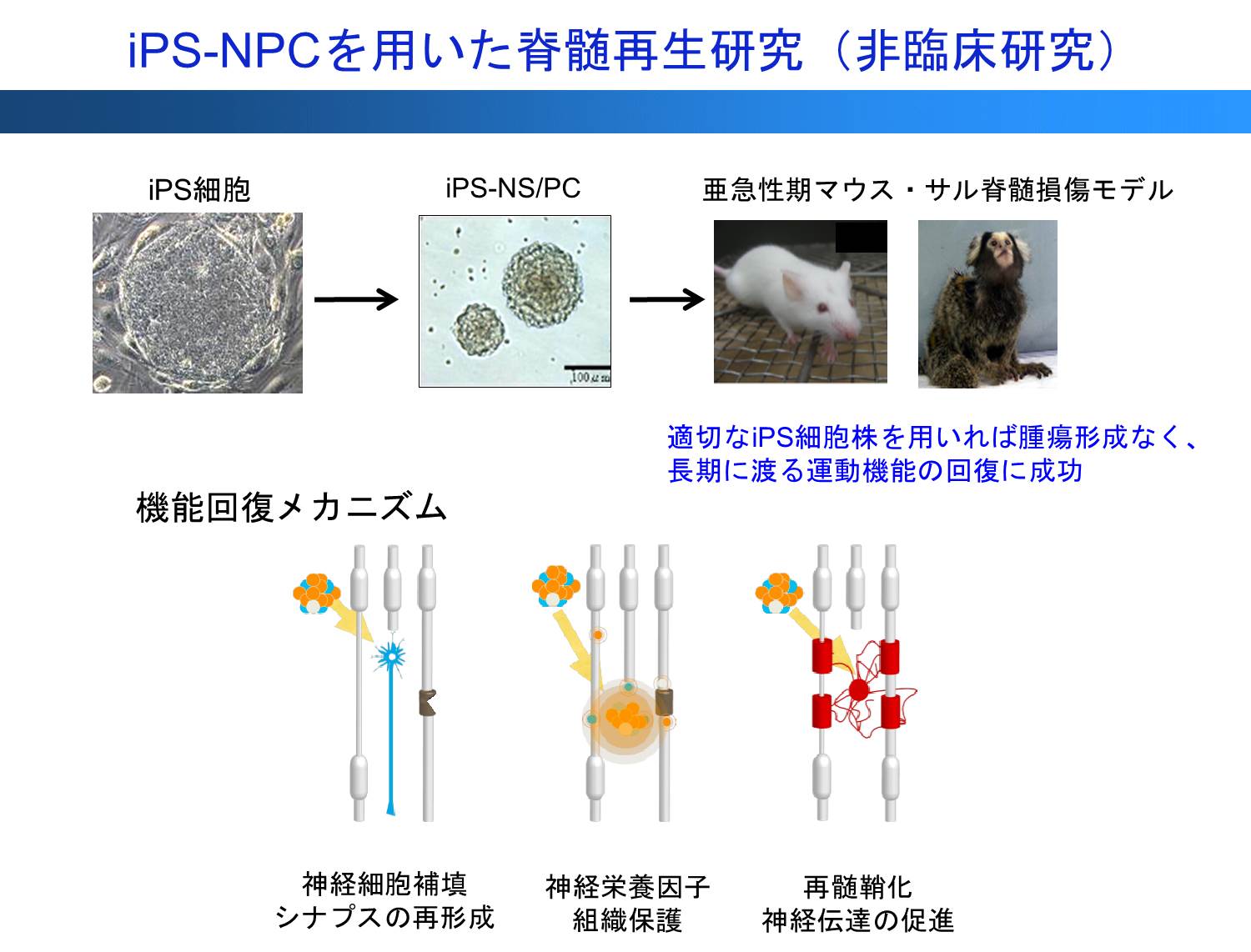
胎児由来細胞の代わりとして、2006年に発表された山中伸弥教授によるiPS技術を用いて脊髄損傷の再生を目指した研究を開始した。以降、マウス及びヒトiPS細胞から分化誘導した神経前駆細胞をマウスや小型霊長類であるコモンマーモセット脊髄損傷モデルに移植し、その有効性と安全性を報告し、幹細胞治療開発の研究領域において世界をリードする研究を推進してきた(図1)7-10)。しかし同時に、臨床応用に向けてヒトiPS細胞由来神経幹・前駆細胞移植後の造腫瘍性の問題も明らかになった8。其のため、造腫瘍性に関する網羅的解析を進め、iPS細胞の樹立の際の不完全なリプログラミングが造腫瘍性に大きく関与すること4, 8, 9)、またiPS細胞から神経幹・前駆細胞へ分化誘導する際に生じる一部の細胞分画により造腫瘍性をきたすことを明らかにした7,10-12)。 これらを踏まえて、前臨床研究を行い、適切なiPS細胞株を用いる、あるいはFail-safeシステムとして移植前にNotchシグナル抑制効果のあるg-セクレターゼ阻害薬を前処置することにより、腫瘍形成なく、長期に渡る運動機能の回復に成功した13,14)。興味深いことに、移植前にg-セクレターゼ阻害薬を前処置することにより、iPS細胞由来の神経幹・前駆細胞移植は、これまで治療抵抗性を示してきた慢性期の脊髄損傷についても動物実験レベルではあるが治療効果を示した14)。
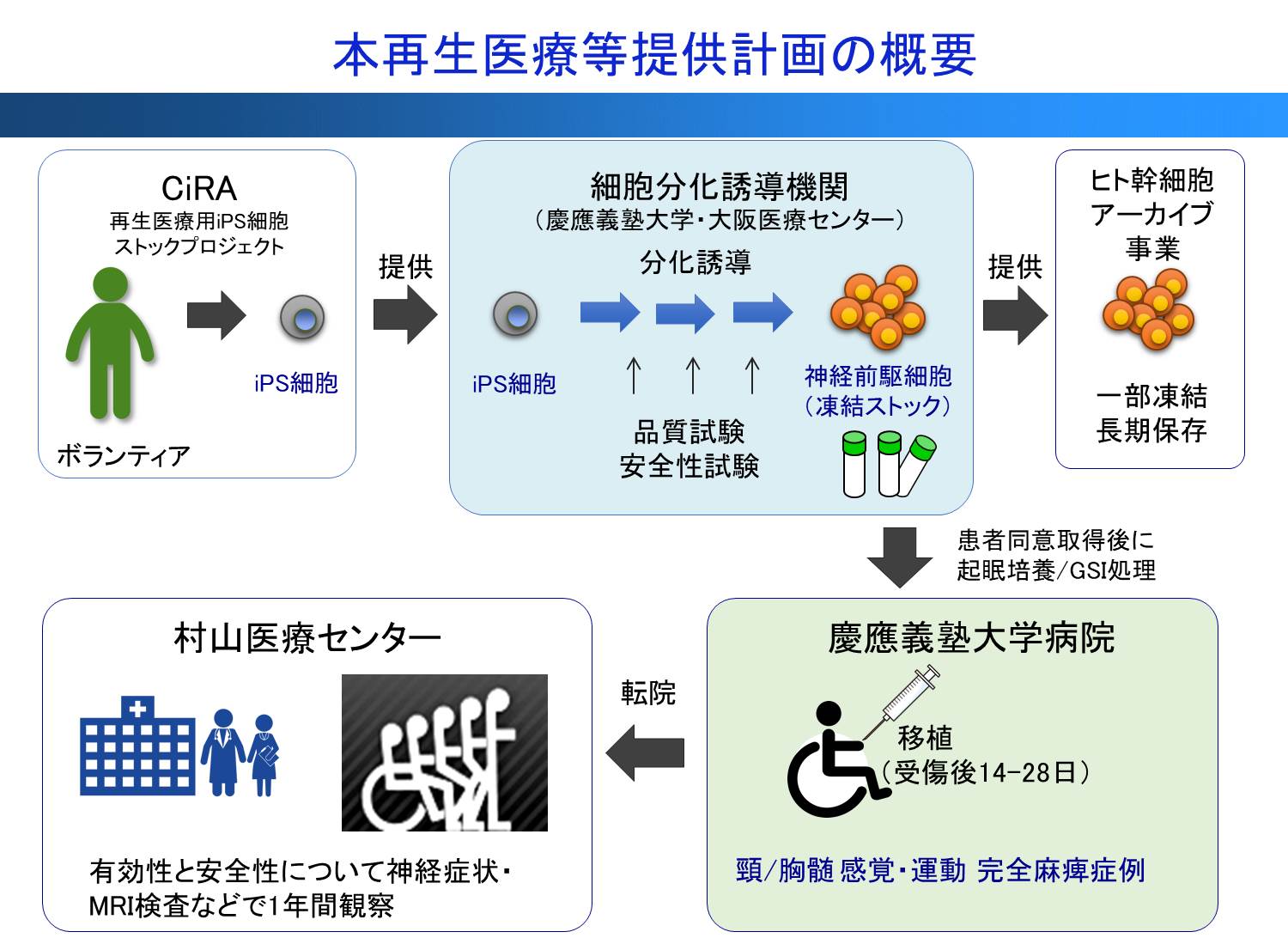
さらに、臨床応用を見据えて、2013年からは京都大学iPS細胞研究所(CiRA)で樹立された臨床研究用iPS細胞ストックを用い、脊髄損傷再生医療用の細胞の調整法の開発を開始した(図2)。脊髄再生のための臨床研究で使用するヒトiPS細胞由来神経前駆細胞の製造法と保存管理体制を確立し、再生医療用iPS細胞由来神経前駆細胞ストックを構築し、これらの細胞を用いた造腫瘍性の解析による安全性スクリーニングおよび移植後の腫瘍化対応策を確立した15,16)。
その後様々な試行錯誤を介して、非臨床研究レベルでiPS細胞由来神経前駆細胞を用いた再生医療の安全性と有効性を確認し、2019年2月には中村雅也教授との共同による「亜急性期脊髄損傷に対するiPS細胞由来神経前駆細胞を用いた再生医療の臨床研究」の計画が厚生労働省の承認を得るに至った。本臨床研究では、亜急性期脊髄損傷(「受傷後14~28日の脊髄損傷」を指す)の患者さんを対象に、主な目的として移植細胞および移植方法の安全性を、また副次的目的として それらの脊髄損傷治療における有効性を確認するものである。 移植細胞は、あらかじめ CiRA から提供を受けた医療用iPS細胞より、慶應義塾大学および大阪医療センターで移植用神経前駆細胞を作製し、凍結ストックとして保存する。研究対象は「亜急性期」と呼ばれる、損傷後14日~28日の患者さんで、なかでも運動機能と感覚が完全に麻痺した重症の患者さん4人に、200万個のiPS細胞由来神経前駆細胞移植する計画である。実際には、本臨床研究への参加に関する同意が得られた場合、凍結保存済みの神経前駆細胞を融解して移植用に最終調製し、脊髄の損傷部位へ移植を行う。移植後は、一定期間の免疫抑制剤の使用、および通常の保険診療の範囲内のリハビリテー ション治療などを行い、約1年間の経過観察を詳しく行う計画である(図3)16)。今後は、移植前にg-セクレターゼ阻害薬を前処置することやリハビリテーション17)、さらには軸索伸長誘導剤5と組み合わせることにより、慢性期の脊髄損傷の治療法開発に邁進したいと考えている。
- 文献
-
- Pincus DW, Keyoung HM, Harrison-Restelli C, Goodman RR, Fraser RA, Edgar M, Sakakibara S, Okano H, Nedergaard M, Goldman SA.: Fibroblast growth factor-2/brain-derived neurotrophic factor-associated maturation of new neurons generated from adult human subependymal cells. Annals of Neurology 43: 576-585, 1998.
- Roy NS, Wang S, Jiang L, Kang J, Benraiss A, Harrison-Restelli C, Fraser RA, Couldwell WT, Kawaguchi A, Okano H, Nedergaard M, Goldman SA.: In vitro neurogenesis by progenitor cells isolated from the adult human hippocampus. Nature Medicine 6: 271-277, 2000.
- Iwanami, A., Kakneko, S., Nakamura, M., Kanemura, Y., Mori, H., Kobayashi, S., Yamasaki, M., Momoshima, S., Ishii, H., Ando, K., Tanioka, Y., Tamaoki, N., Nomura, T., Toyama, Y. and Okano, H.: Transplantation of human neural stem/progenitor cells promotes functional recovery after spinal cord injury in common marmoset. J. Neurosci.Res. 80: 182-190, 2005.
- Okada S, Nakamura M, Katoh H, Miyao T, Shimazaki T, Ishii K, Yamane J, Yoshimura A, Iwamoto Y, Toyama Y, Okano H.: Conditional ablation of Stat3 or Socs3 discloses a dual role for reactive astrocytes after spinal cord injury. Nature Medicine12: 829-834, 2006.
- Kaneko S, Iwanami A, Nakamura M, Kishino A, Kikuchi K, Shibata S, Okano HJ, Ikegami T, Moriya A, Konishi O, Nakayama C, Kumagai K, Kimura T, Sato Y, Goshima Y, Taniguchi M, Ito M, He Z, Toyama Y, and Okano H: A selective Sema3A-inhibitor enhances regenerative responses and functional recovery of the injured spinal cord. Nature Medicine12(12): 1380-1389, 2006.
- Renault-Mihara F, Katoh H, Ikegami T, Iwanami A, Mukaino M, Yasuda A, Nori S, Mabuchi Y, Tada H, Shibata S, Saito K, Matsushita M, Kaibuchi K, Okada S, Toyama Y, Nakamura M, Okano H.: Beneficial compaction of spinal cord lesion by migrating astrocytes through glycogen synthase kinase-3 inhibition. EMBO Mol Med. 3(11): 682-696, 2011.
- Miura K, Okada Y, Aoi T, Okada A, Takahashi K, Okita K, Nakagawa M, Koyanagi M, Tanabe K, Ohnuki M, Ogawa D, Ikeda E, Okano H, Yamanaka S.: Variation in the safety of induced pluripotent stem cell lines Nature Biotechnol. 27(8): 743-745, 2009.
- Tsuji O, Miura K, Okada Y, Fujiyoshi K, Nagoshi N, Kitamura K, Kumagai G, Mukaino M, Nishino M, Tomisato S, Higashi H, Ikeda E, Nagai T, Kohda K, Takahashi K, Okita K, Katoh H, Matsuzaki Y, Yuzaki M, Toyama Y, Nakamura M, Yamanaka S and Okano H.: Therapeutic effect of the appropriatelly evaluated 'safe' iPS cells for spinal cord injury. Proc.Natl.Acad.Sci.USA 107(28): 12704-12709, 2010.
- Nori S, Okada Y, Yasuda A, Tsuji O, Takahashi Y, Kobayashi Y, Fujiyoshi K, Koike M, Uchiyama Y, Ikeda E, Toyama Y, Yamanaka S, Masaya N, Okano H.: Grafted human induced pluripotent stem cell-derived neurospheres promotes motor functional recovery after spinal cord injury in mice. Proc.Natl.Acad.Sci.USA 108(40): 16825-16830, 2011.
- Nori S, Okada Y, Nishimura S, Sasaki T, Itakura G, Kobayashi Y, Renault-Mihara F, Shimizu A, Koya I, Yoshida R, Kudoh J, Koike M, Uchiyama Y, Ikeda E, Toyama Y, Nakamura M, Okano H.: Long-term safety issues associated with iPSC-based cell therapy in a spinal cord injury model: Oncogenic transformation with epithelial-mesenchymal transition. Stem Cell Reports, 4(3):360-373, 2015.
- Iida T, Iwanamia A, Sanosaka T, Kohyama J, Miyoshi H, Nagoshi N, Kashiwagi R, Toyama Y, Matsumoto M, Nakamura M and Okano H: Whole-genome DNA methylation analyses revealed epigenetic instability in tumorigenic human iPS cell-derived neural stem/progenitor cells. Stem Cells, 35(5):1316-1327, 2017.
- Okano H, Nakamura M, Yoshida K, Okada Y, Tsuji O, Nori S, Ikeda E, Yamanaka S, Miura K.: Steps toward safe cell therapy using induced pluripotent stem cells. Circulation Research, 112(3):523-533, 2013.
- Okubo T, Iwanami A, Kohyama J, Itakura G, Kawabata S, Nishiyama Y, Sugai K, Ozaki M, Iida T, Matsubayashi K, Matsumoto M, Nakamura M and Okano H.: Pretreatment with gamma-secretase inhibitor prevents tumor-like overgrowth in human iPSC-derived transplant for spinal cord injury. Stem Cell Reports, 7(4):649-663, 2016.
- Okubo T, Nagoshi N, Kohyama J, Tsuji O, Shinozaki M, Shibata S, Kase Y, Matsumoto M, Nakamura M, Okano H.: Treatment with a Gamma-Secretase Inhibitor Promotes Functional Recovery in Human iPSC- Derived Transplants for Chronic Spinal Cord Injury. Stem Cell Reports, 11(6):1416-1432, 2018.
- Nagoshi N, Okano H: Applications of induced pluripotent stem cell technologies in spinal cord injury. J Neurochem, 141(6):848-860, 2017.
- Tsuji O, Sugai K, Yamaguchi R, Tashiro S, Nagoshi N, Kohyama J, Iida T, Ohkubo T, Itakura G, Isoda M, Shinozaki M, Fujiyoshi K, Kanemura Y, Yamanaka S, Nakamura M, Okano H: Laying the groundwork for a first-in-human study of an iPSC-based intervention for spinal cord injury. Stem Cells, 37(1):6-13, 2019.
- Tashiro S, Nishimura S, Iwai H, Sugai K, Zhang L, Shinozaki M, Iwanami A, Toyama Y, Liu M, Okano H, Nakamura M: Functional recovery from neural stem/progenitor cell transplantation combined with treadmill training in mice with chronic spinal cord injury. Sci Rep. 6:30898, 2016.
角膜上皮の再生医療―体細胞からiPS細胞へ
大阪大学ヒューマン・メタバース疾患研究拠点(WPI-PRIMe)
西田 幸二
寄稿日(2023年3月)
- 1.角膜上皮幹細胞と角膜上皮幹細胞疲弊症
角膜上皮は角膜の最表層に存在する厚さ約50µmの重層扁平上皮であり、表層細胞のタイトジャンクションやムチン産生により外界とのバリア機能を担っている。角膜上皮幹細胞は、角膜と結膜の境界に位置する輪部と呼ばれる組織の上皮基底部に存在し、角膜上皮のホメオスタシスを維持している。Stevens-Johnson症候群や眼類天疱瘡、熱傷、化学外傷などの重篤な眼表面疾患により、輪部の角膜上皮幹細胞が消失あるいは機能不全に陥ると、幹細胞からの角膜上皮細胞の供給が行われないため、隣接する結膜上皮が侵入し、角膜混濁など重篤な視力障害が起きる。
- 2.体細胞由来・培養角膜上皮シート移植
角膜上皮幹細胞疲弊症に対して、幹細胞を補うコンセプトの下、アロ輪部移植が行われたが、重症眼表面疾患では免疫学的な問題のため、その予後は不良であった1)。そこでアロ移植における拒絶反応を解決するために開発されたのが自家細胞を用いた培養角膜上皮移植である。培養角膜上皮移植の最初の成功例を示したのは1997年のPellegriniらの報告である2)。彼女らは、片眼性の角膜上皮幹細胞疲弊症に対し、健常眼の角膜輪部組織を少量採取し、3T3細胞と共培養して重層化した角膜上皮シートを作製、コンタクトレンズ上にのせて移植した。続いて、角膜上皮細胞を羊膜やフィブリンゲルなどの基質上で培養して作製したシートを移植する方法が報告された3, 4)。しかし、これらの方法では酵素処理に伴いシートが脆弱化することや基質とホスト角膜実質との接着が不良であることなど課題が残されていた。
筆者らは、上記の問題を解決すべく温度応答性培養皿を用いた独自の自家培養上皮細胞シート移植法を世界に先駆けて開発した5)。この培養皿上で培養した上皮細胞は酵素処理を必要とせず、温度を下げるという極めて非侵襲的な方法により、培養皿から培養上皮細胞のみシート状で回収することが可能となる。我々は、本技術を用いて作製した培養角膜上皮細胞シートを片眼性の角膜上皮幹細胞疲弊症患者に移植する治験を行い、その有効性及び安全性を検証した。その結果、本製品は現在ネピックとして本邦初の眼科領域の再生医療製品として承認された。- 3.体細胞由来・培養口腔粘膜上皮シート移植
片眼性の疾患については瞭眼から健常な輪部組織を採取し、角膜上皮シートを作製することが可能であるが、全身性の疾患であるStevens-Johnson症候群や眼類天疱瘡など両眼性の難治性角結膜上皮疾患では、自己の輪部上皮を細胞ソースに用いることは不可能である。そこで筆者らは、細胞ソースとして自己由来の細胞を用いることにこだわり、口腔粘膜細胞上皮を用いて眼表面再建を行う独自の治療法の開発に成功した6)。方法は、自己の口腔粘膜組織を少量採取後に、上皮細胞を単離し、温度応答性培養皿上で培養して培養口腔粘膜上皮細胞シートを作製する。出来上がったシートは透明であり、角膜上皮幹細胞から作製したシートと同様のバリア機能を有していることを証明した。筆者らは自家培養上皮細胞シート移植の臨床研究、さらに多施設共同医師主導治験を行い、その結果をもとにオキュラルとして本邦2品目の眼科領域再生医療製品として承認を得ている。
- 4.iPS細胞由来・角膜上皮シート移植
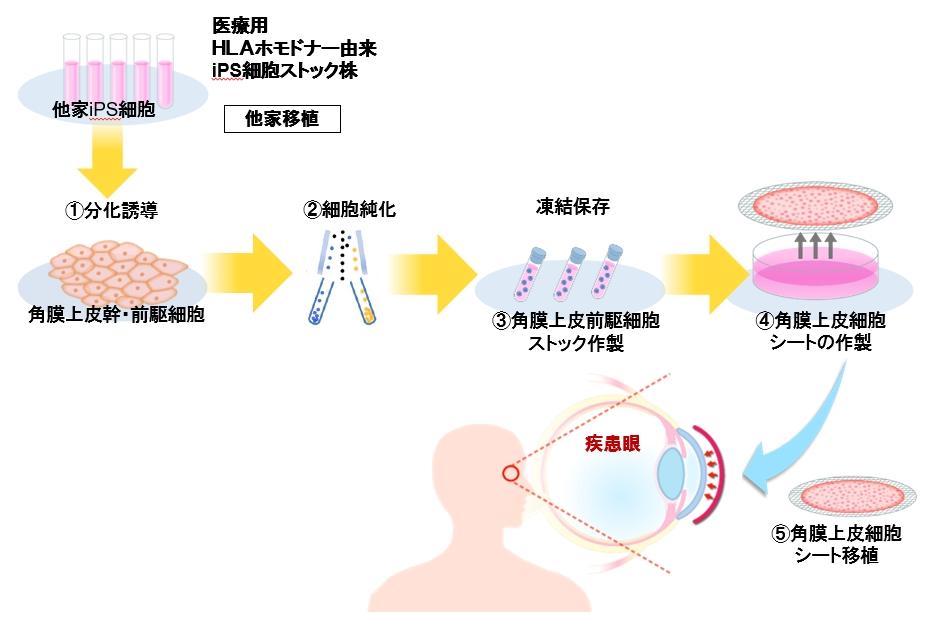
山中らが開発したiPS細胞は臨床応用に向けた応用研究が加速的に進められ、2014年に理化学研究・高橋政代らの研究チームにより、世界初のiPS細胞由来網膜色素上皮細胞移植が行われた7)。これに対し我々は近年、ヒトiPS細胞を用いた角膜や網膜等の原基を含む眼の細胞系譜が層状に規則正しく配行したコロニーであるSEAM(self-formed ectodermal autonomous multi-zone)の誘導法を開発し、そのなかから角膜上皮幹細胞・前駆細胞を単離し、角膜上皮組織を作製可能であることを世界に先駆けてNature誌に報告した8, 9)。SEAM法により作製した角膜上皮組織は角膜上皮分化マーカーを発現する機能的な上皮シートであり、動物実験により角膜上皮バリア機能の再建が可能であることが示された。
iPS細胞の細胞源については、拒絶反応を回避するために自己のiPS細胞を用いる自家移植が理想的であるが、iPS細胞の樹立や目的細胞への分化誘導が不安定、高コスト、作製に長期間(数か月~1年)を要するといった課題がある。近年、自己のiPS細胞を用いた自家移植にかわって、複数のHLAホモドナー由来iPS細胞をストックし、HLAが適合したiPS細胞を用いる他家移植が京都大学iPS細胞研究所(CiRA)を中心に進められている。このiPS細胞を用いると自家移植と比較してiPS細胞が均質、製造期間が短い(数週間)、低コストといった利点があるが、HLA適合移植では適応患者が限定される欠点がある。我々は、培養角膜上皮シート移植ではHLA不適合であっても免疫反応はHLA適合と同等で、薬剤によってコントロール可能であることをカニクイザルを用いた検討で見出した10)。そこで、このHLAホモドナー由来iPS細胞を用いた他家角膜上皮細胞シート移植の臨床試験を計画し、2019年3月に国の承認を得た(図)。同年7月には世界に先駆けて1例目のiPS細胞由来角膜上皮細胞シート移植を施行し、続いて全4例のシート移植を行った。全例の術後1年の経過観察が完了し、安全性、有効性を示す結果が得られた。
組織工学の技術を応用することでこれまでに大きく進歩してきた角膜上皮の再生治療は、iPS細胞をいう新しいツールが加わった今、ますます発展していくと予想される。医療として確立し、そして成熟するためには効果と安全性、コストのバランスが取れた治療法である必要がある。我々を含めて今後のさらなる研究が望まれる。
- 文献
-
- 1. Kenyon KR, Tseng SC.: Limbal autograft transplantation for ocular surface disorders. Ophthalmology 96:709-722, 1989.
- Pellegrini G, Traverso CE, Franzi AT, et al.: Long-term resroration od damaged corneal surfaces with autologous cultivated corneal epithelium. Lancet 349: 990-993, 1997.
- Tsai RJ, Li LM, Chen JK: Reconstruction of damaged corneas by transplantation of autologous limbal cells. N Engl J Med 13: 86-93, 2000.
- Koizumi N, Inatomi T, Suzuki T, et al.: Cultivated corneal epithelial stem cell transplantation in ocular surface disorders. Ophthalmology 108:1569-1574, 2001
- Nishida K, Yamato M, Hayashida Y, et al.: Functional bioengineered corneal epithelial sheet grafts from corneal stem cells expanded ex vivo on a temperature-responsive cell culture surface. Transplantation 77:379-385, 2004.
- Nishida K, Yamato M, Hayashida Y, et al.: Corneal Reconstruction Using Tissue-Engineered Cell Sheets Comprising Autologous Oral Mucosal Epithelium. N Engl J Med 351: 1187-1196, 2004.
- Mandai M, Watanabe A, Kurimoto Y, et al.: Autologous Induced Stem-Cell-Derived Retinal Cells for Macular Degeneration. N Engl J Med 376: 1038-1046, 2017.
- Hayashi R, Ishikawa Y, Sasamoto Y, et al.: Co-ordinated ocular development from human iPS cells and recovery of corneal function. Nature 531:376-380, 2016.
- Hayashi R, Ishikawa Y, Katori R, et al.: Coordinated generation of multiple ocular-like cell lineages and fabrication of functional corneal epithelial cell sheets from human iPS cells. Nat Protoc. (4):683-696 2017
- Yoshinaga Y, Soma T, Azuma S, et al: Long-term survival in non-human primates of stem cell-derived, MHC-unmatched corneal epithelial cell sheets. Stem Cell Reports 17:1714-1729, 2022.