- ゲノム編集を活用した遺伝子変異修復、免疫拒絶回避、生体内送達
京都大学 iPS細胞研究所 臨床応用研究部門 堀田 秋津(寄稿日:2024年3月) new! - iPS細胞を用いたT細胞の再生と治療開発
京都大学iPS細胞研究所 金子 新(寄稿日:2023年5月) - 膵臓の発生分化再生研究
東京工業大学 生命理工学院 粂 昭苑(寄稿日:2023年3月) - Tissue Engineeringの最前線~細胞を元気にする細胞バイオテクノロジー技術~
京都大学医生物学研究所 生体材料学分野 田畑 泰彦
(寄稿日:2023年3月) - 消化管吸収の謎を解明する実験外科技術―最近のトピックより
東京慈恵会医科大学 産学連携講座 腎臓再生医学講座 小林 英司
(寄稿日:2022年6月) - ES細胞のプロジェクトについて
国立成育医療研究センター 梅澤 明弘(寄稿日:2022年4月) - ヒューマン・オルガノイド研究の可能性
東京医科歯科大学 統合研究機構 先端医歯工学創成研究部門 武部 貴則(寄稿日:2019年12月) - 胚盤胞補完法の現状と展望
東京大学医科学研究所 幹細胞治療部門 山口 智之(寄稿日:2020年5月) - 消化器外科領域の再生医療
長崎大学大学院移植・消化器外科/消化器再生医療学講座 丸屋 安広、小林 慎一朗、金高 賢悟、江口 晋
(寄稿日:2020年5月) - 東京医科歯科大学消化器内科・上皮研究分野の紹介
東京医科歯科大学 消化器内科 油井 史郎(寄稿日:2019年3月) - 脱細胞化臓器骨格技術
慶應義塾大学 医学部外科学 八木 洋(寄稿日:2019年3月) - 再生医療を支える培養技術の貢献
大阪大学大学院工学研究科 紀ノ岡 正博(寄稿日:2019年3月) - 生体が持つ天然のデリバリーシステムであるエクソソームに学ぶ
東京医科大学 医学総合研究所 分子細胞治療研究部門 落谷 孝広
(寄稿日:2019年3月) - オルガノイド
東京医科歯科大学 再生医療研究センター 消化器病態学 岡本 隆一、高橋 純一、油井 史郎(寄稿日:2019年2月) - 肝臓の発生・再生における肝前駆細胞
東京大学 定量生命科学研究所 宮島 篤(寄稿日:2019年2月)
肝臓の発生・再生における肝前駆細胞
東京大学 定量生命科学研究所
宮島 篤
寄稿日(2019年2月)
- 肝臓の発生・分化
肝臓における幹/前駆細胞は、肝臓の上皮系細胞である肝細胞と胆管上皮細胞に分化する能力をもった増殖性の細胞であると考えられている。胎児期の肝幹細胞とみなされている肝芽細胞は、前腸上皮細胞から心臓由来のFGFおよび横中隔間充織由来のBMPの作用により発生して、内皮細胞や間葉系細胞とともに肝芽を形成する。肝芽が形成されると、そこに造血幹細胞が流入し造血が行われる。哺乳類の肝臓は胎児期には主要な造血器官として機能し、出生後に代謝器官へと成熟する。
発生初期の肝芽に発現する細胞膜タンパク質としてDlkやEpCAMなどが同定されており、これらに対するモノクローナル抗体を用いて細胞を分離・培養することにより、肝芽には高い増殖能と肝細胞と胆管上皮細胞への分化能を併せ持つ細胞が存在することが示されている。肝芽細胞は増殖して肝細胞と胆管上皮細胞へと分化するが、胆管は門脈周囲にのみ形成される。肝芽細胞はNotch2を発現しており、そのリガンドである膜タンパク質Jagged1が門脈域の線維芽細胞に発現しており、これが胆管上皮への分化を誘導する要因である。1)- 成体肝臓の再生
成体肝臓においては、成熟肝細胞は非常にゆっくりとターンオーバーしており、部分肝切除後の再生は残存する肝細胞の肥大と増殖による。また、四塩化炭素の単回投与などによる急性肝障害からの修復も、基本的には残存肝細胞の増殖による。一方、慢性的で重篤な肝障害時には、小型で楕円形の核をもつoval細胞が出現することが知られている1)。この細胞は、胆管様構造の増加を伴って出現することから、細胆管増生、偽胆管増生や細胆管反応(ductular reaction)などとも呼ばれている。この細胞は、胎児期の肝芽細胞のようにin vitroでの増殖能と二分化能を併せ持ち、肝細胞の増殖による肝再生が制限された場合に現れる “Facultative stem cell”であるとする考えが広まり、肝前駆細胞(LPC)とも呼ばれている。しかし、LPC/oval細胞の研究は組織化学的な解析がほとんどで、その実体は長らく不明であった1)。
- 肝細胞の再生とLPC
LPC/ductular reactionを伴うマウス肝障害モデルの研究から、分離したLPCおよび正常胆管細胞には、in vitroでクローナルに増殖し、肝細胞と胆管細胞への二方向性分化能を有する細胞が含まれることが示された。また、両者の遺伝子発現はよく似ていることから、LPCは胆管から派生する可能性が示された。この細胞が肝細胞にもin vivoで分化するのかという点に関して、活発な議論があった。Cre組み換え酵素を使った細胞系譜解析から、DDCなどによる肝障害からの回復過程で生じる新たな肝細胞の大部分は既存の肝細胞に由来するものであり、胆管あるいはLPCに由来する肝細胞はほとんどないことから、LPCの肝再生への関与を否定する報告が相次いでなされた(図2)2,3,4)。一方、肝細胞の増殖を抑制した状態で肝障害を誘導した場合には、再生肝細胞はLPCから生じるという報告もある(図2)5,6)。いずれも細胞系譜解析による結果であるが、このように相反する結果が報告されている。こうした違いはおそらく肝障害モデルの違いを反映していると考えられる。すなわち、肝障害でも正常な肝細胞が残存していれば、それが増殖することで新たな肝細胞を生み出すが、肝細胞の増殖が著しく制限された状況下での肝障害では、LPCや胆管から肝細胞が供給されるものと考えられる。
Font-Burgadaらは門脈周囲には胆管上皮細胞と肝細胞との性質を併せ持つhybrid hepatocyteが存在しており、それが障害に応じて増殖するという結果を報告した7)。一方、Wangらは中心静脈の周囲にWntシグナルにより制御されるAxin2を発現する細胞が存在していて、それが定常状態で肝細胞を生み出す幹細胞であるという結果を報告した8)。さらに最近, 実質域に存在するTERTを高発現する細胞から肝細胞が供給されるという報告もあり9)、成体肝臓の幹細胞/前駆細胞については、現在も議論が続いている(図2)。- 細胆管増生の生理的意義
DDCなどによる肝障害は胆管マーカー陽性細胞の増殖を誘導するが、もしそれらが肝細胞の再生にほとんど寄与してないとすると、この増殖性細胞は何なのか? 従来の研究では、肝臓切片の免疫染色で胆管マーカー陽性細胞をLPCやoval細胞と定義していた。しかし、障害により増殖する胆管マーカー陽性の細胞が胆管とどういう関係なのか?従来の組織切片の免疫染色による解析からではこの点が明らかでなかった。
総胆管からインクを注入してから肝臓切片を胆管マーカーCK19抗体で染色すると、2次元の肝組織切片上のほぼ全てのCK19陽性細胞クラスターにインクが存在していたことから、障害で増幅した胆管マーカー陽性細胞は胆管そのものであることを示し、さらに、樹状構造は肝障害により異なることも明らかになった(図3)10)。門脈周囲の肝細胞を障害するDDCやCDEモデルでは門脈域で激しく胆管の増生が見られるが、長期のCCL4やTAAの投与による障害モデルでは、中心静脈周囲の肝細胞が障害されるが、門脈域から胆管がそちらに向かって伸長する様子が観察された。(図3)11)
さらに、蛍光胆汁を尾静脈から投与し生体肝臓を2光子蛍光顕微鏡で観察することで胆汁の流れをin vivoで可視化することができる。このシステムにより胆管増生を誘導すると胆汁の流れが激しくなることが確認された。TAAの長期投与により中心静脈域に障害を誘導すると、門脈域の胆管がそちらに向かって伸長する。障害により中心静脈域のbile canaliculiが破壊されるが、門脈域から伸長してきた胆管が胆汁を回収する様子が観察された。従って、胆管増生の重要な生理的意義は胆汁の排出にあると考えられる。- おわりに
肝臓の発生や再生に関する研究は近年急速に発展しており、その機構の詳細が明らかにされつつある。とりわけ細胞系譜解析法は、細胞の運命を追跡することを可能とした画期的な技術であり、肝臓再生において新たに生じた肝細胞や胆管細胞の起源に迫ることが可能となった。しかし、上述のように細胞系譜解析で得られた結果が研究者により大きく異なる場合があり、解釈には注意が必要である。また、マウス障害モデルでの結果がヒトの病理像をマウスモデルがどこまで反映しているのかという観点からマウスでの研究成果を評価することも必要であろう。
- 文献
-
- Miyajima A, Tanaka M and Itoh T. : Stem/progenitor cells in liver development, homeostasis, regeneration, and reprogramming. Cell Stem Cell 14: 561-574, 2014.
- Malato, Y. et al : Fate tracing of mature hepatocytes in mouse liver homeostasis and regeneration. J Clin Invest 121: 4850-4860, 2011.
- Yanger, K. et al : Robust cellular reprogramming occurs spontaneously during liver regeneration. Genes Dev 27: 719-724, 2013.
- Tarlow BD et al : Bipotential adult liver progenitors are derived from chronically injured mature hepatocytes. Cell Stem Cell 15: 605-182014, 2014.
- Lu WY et al : Hepatic progenitor cells of biliary origin with liver repopulation capacity. Nat Cell Biol. 17: 971-983, 2015.
- Raven A et al. Cholangiocytes act as facultative liver stem cells during impaired hepatocyte regeneration. Nature 547: 350-354, 2017.
- Font-Burgada J et al : Hybrid periportal hepatocytes regenerate the injured liver without giving rise to cancer. Cell 162:766-779, 2015.
- Wang B et al : Self-renewing diploid Axin2(+) cells fuel homeostatic renewal of the liver. Nature 524:180-185, 2015.
- Lin et al. : Distributed hepatocytes expressing telomerase repopulate the liver in homeostasis and injury. Nature 556:244-248, 2018.
- Kaneko K et al. : Adaptive remodeling of the biliary architecture underlies liver homeostasis. Hepatology 61: 2056-2066, 2015.
- Kamimoto Ket al.: Heterogeneity and stochastic growth regulation of biliary epithelial cells dictate dynamic epithelial tissue remodeling. eLife: e15034, 2017.
-
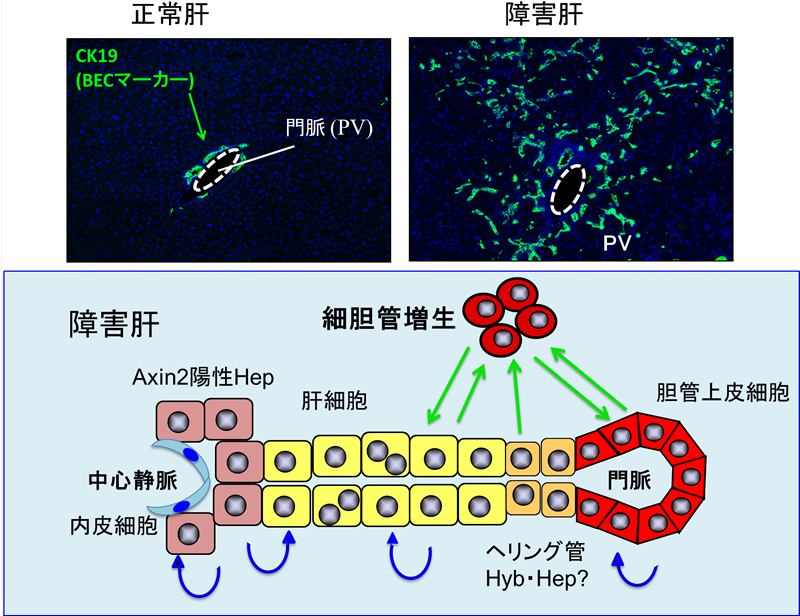
図1 胆管増生
薬剤等による慢性の重篤な障害により、門脈周囲に胆管のマーカーを発現する細胞が出現し、それが肝細胞と胆管の(幹)前駆細胞であると考えられていた。肝障害から新たに再生した肝細胞の起源について、既存の肝細胞が分裂増殖するという結果と、胆管から出現するという報告がある。また、胆管と肝細胞索との間のヘリング管に肝前駆細胞が存在するという報告、さらに中心静脈周囲のAxin2陽性の肝細胞が定常状態の幹細胞として新たな肝細胞を生み出しているという報告もあり、議論が続いている。
-
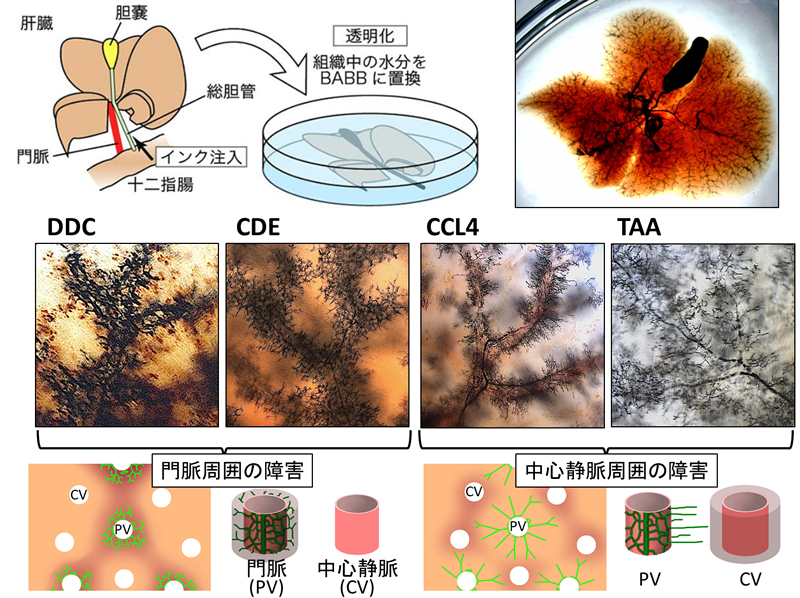
図2 胆管の樹状構造の可視化
総胆管からインクを逆向性に注入してから、肝臓を丸ごとBABBという溶液に浸して透明化すると、肝臓内の胆管の樹状構造が可視化できる。様々な肝障害による細胆管反応を可視化すると、門脈域に障害を誘導するモデル(DDC, CDE)では門脈期で細い胆管が多数出現するが、中心静脈域で障害を誘導するモデル(CCL4やTAAの長期投与)では、門脈域の胆管が中心静脈域に向かって伸長する様子が認められる。文献10の図を改変
-
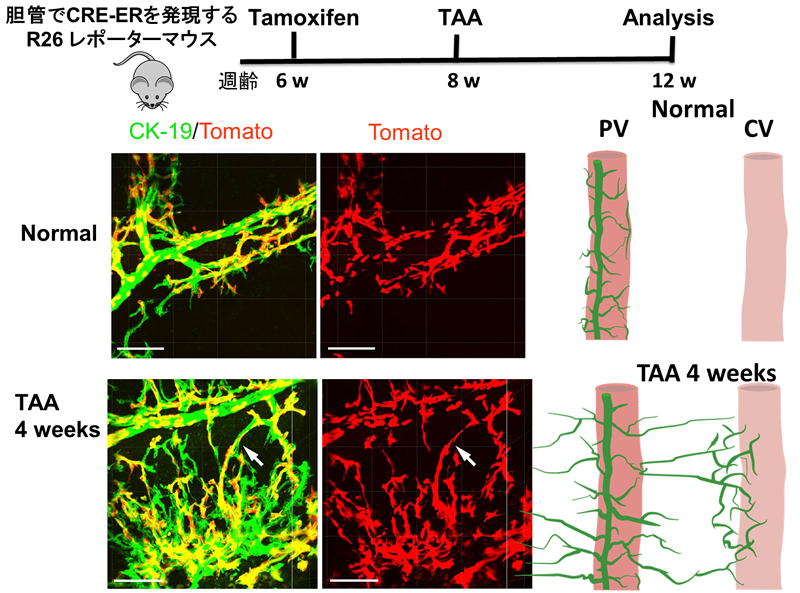
図3 細胆管反応の可視化と細胞系譜
胆管で発現するCD133プロモーターでCRE-ERTを発現するレポーターマウスにTamoxifenを投与して胆管をTdTomato(赤)で標識後に、TAAを4週間与えると、標識された胆管が中心静脈域に達して増幅している様子が観察される。文献11の図を改変
オルガノイド
東京医科歯科大学 再生医療研究センター
消化器病態学
岡本 隆一、高橋 純一、油井 史郎
寄稿日(2019年2月)
- オルガノイドとは?
「オルガノイド」は別名「ミニ臓器」と称される、3次元構造を有する培養単位を指す言葉として近年急速に普及してきました。オルガノイド研究の分野において、本邦の多くの研究者が先駆的な役割を担ってきたことも特筆すべき特徴です。 「オルガノイド」には大きく分けてiPS細胞・ES細胞などの多能性幹細胞から分化誘導を経て得られるものと、生体に内在する体性幹細胞により構成されるものの2通りがあります(表)。多能性幹細胞から分化誘導される消化器領域のオルガノイドとしては肝臓(Organ bud, Takebeら)や腸 (Spenceら)が挙げられます。これら多能性幹細胞から得られる「ミニ肝臓」や「ミニ腸」は複雑な分化誘導工程を経るための時間と高度な技術を要しますが、当該臓器を構成する複数種の細胞で構成されるミニ臓器を作ることができるという強みを持っています。 一方、体性幹細胞から得られる消化器領域のオルガノイドとしては胃上皮(Barkerら)・腸上皮(Satoら)・膵管上皮(Bojら)・胆管上皮(Huchら)・肝細胞(Huら)が挙げられます。体性幹細胞から得られるオルガノイドは内視鏡生検組織等の微小な臨床検体(組織片)から培養増殖させることが可能で、複雑な分化誘導工程も不要ですが、上皮細胞や肝細胞等の単一種の細胞で構成されるより単純化された「ミニ臓器」であるという特徴を持っています。
- オルガノイドを培養する技術とは?
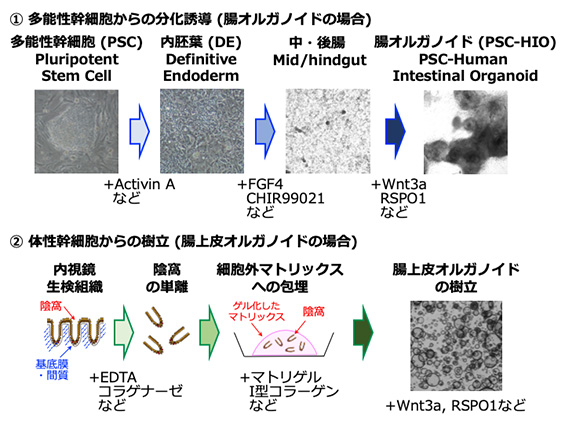
オルガノイドを培養する技術は臓器の発生過程や生体内の幹細胞を維持する仕組みと深い関わりがあります。例えば多能性幹細胞から「ミニ腸」を創る場合は、生体における腸の発生過程に沿い、多能性幹細胞から内胚葉、中・後腸へと順に分化誘導を行ってはじめて「ミニ腸」を得ることができます(図, 上段)。各々の分化誘導の工程では各ステージの細胞が発生過程で受けるべき外的刺激(増殖因子や細胞外マトリックスなどによる分化誘導刺激)を適切な期間と量の範囲で加えることにより、次のステージの細胞へと分化誘導することが可能です。一方、体性幹細胞から「腸上皮オルガノイド」を樹立する場合は、生体内の腸上皮幹細胞が維持される微小環境(“幹細胞ニッチ”と言います)を忠実に再現することが極めて重要であることが分かっています(図,下段)。このため、複数の増殖因子(Wnt3a, R-Spondin1, EGF, Noggin等)を培地に加えたり、適切な細胞外マトリックス(マトリゲルやI型コラーゲン)に細胞を包埋したりすることが重要です。反対に腸上皮オルガノイドの培養に必須な因子を見つけることにより、生体内の“幹細胞ニッチ”を構成する重要な因子とは何か、を解明することにも役立っています。
- たとえば「腸上皮オルガノイド」はどのように培養するの?
消化管内視鏡生検組織などの微小な臨床検体から「腸上皮オルガノイド」を樹立し維持する為にはいくつかの工程を経る必要があります(Satoら)。まず、微小な生検組織から腸上皮幹細胞を含む単位構造である陰窩(=Crypt)を「単離」する必要があります(図,下段)。この際には EDTA等を使って基底膜から上皮細胞を遊離させたり、コラナーゼ等を使って周囲組織を消化したりする方法が使われます。「単離」した陰窩は細胞外マトリックスに「包埋」します。マトリゲルやI型コラーゲン(Yuiら)等の天然マトリックスのほか、人工マトリックス内でも腸上皮オルガノイドが培養可能であることが示されています。一方、用いるマトリックスにより「腸上皮オルガノイド」の形態や性質が大きく変容することも明らかとされています(Yuiら)。マトリックスに包埋した「陰窩」は適切な活性量のWnt3a, R-Spo1, EGF, Noggin等を含む培地中で培養維持することにより3次元構造を持つ「腸上皮オルガノイド」となり、「金平糖型」あるいは「シスト型」のいずれかの形態で増殖させることができます。大きくなった腸上皮オルガノイドは適切な溶解試薬でマトリックスを除いた後、適宜小断片に破砕し再包埋する「継代」操作を行うことにより、継続してより多くの腸上皮オルガノイドに増やしていくことが可能です。一連の操作には従来多くの高額な試薬と経験が必要でしたが、近年は複数の企業から「腸上皮培養キット」が販売されており、細胞培養の基本技術があれば比較的容易に臨床検体から「腸上皮オルガノイド」を樹立・培養し解析を行うことが可能となっています。
- 臨床検体から「オルガノイド」を培養するとどのように役立つ?
オルガノイドは生体内により近い細胞・組織の状態を体外で再現し、かつ増やすことが可能であることから、消化器疾患においても様々な活用が進められています。例えば胃・腸などのがん組織からオルガノイドを作り「疾患モデル」として解析することで、がん組織の成り立ちや増殖を支える分子機構のより詳細な解明が可能となっています(Nankiら)。また上皮細胞・間葉系細胞・神経細胞等を含む多能性幹細胞由来の「腸オルガノイド」や(Watsonら, Uchidaら)、上皮オルガノイドと免疫担当細胞などを共培養する「疾患モデル」(Nozakiら)を用いることで、病態における複数細胞種の相互作用を解明したり、新たな薬剤のスクリーニングを行ったりすることも可能となっています。更に、本邦では分化誘導した「ミニ肝臓」や「腸上皮オルガノイド」そのものを移植し治療に用いる再生医療の開発も進められています(Takebeら, Okamotoら)。将来的にはこれら技術と3Dバイオプリンター等の他領域の新しい技術が融合・発展し、より高度な体外臓器を構築できるようになることで、さまざまな疾患により失われた肝臓や腸の機能を回復させる画期的な再生医療が誕生することも期待されています。
- 文献
-
- Takebe T, Sekine K, Enomura M, Koike H, Kimura M, Ogaeri T, Zhang RR, Ueno Y, Zheng YW, Koike N, Aoyama S, Adachi Y, Taniguchi H. Vascularized and functional. human liver from an iPSC-derived organ bud transplant. Nature. 2013 499(7459):481-4.
- Spence JR, Mayhew CN, Rankin SA, Kuhar MF, Vallance JE, Tolle K, Hoskins EE,Kalinichenko VV, Wells SI, Zorn AM, Shroyer NF, Wells JM. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 2011 Feb 3;470(7332):105-9.
- Barker N, Huch M, Kujala P, van de Wetering M, Snippert HJ, van Es JH, Sato T,Stange DE, Begthel H, van den Born M, Danenberg E, van den Brink S, Korving J,Abo A, Peters PJ, Wright N, Poulsom R, Clevers H. Lgr5(+ve) stem cells drive self-renewal in the stomach and build long-lived gastric units in vitro. Cell Stem Cell. 2010 Jan 8;6(1):25-36.
- Sato T, Vries RG, Snippert HJ, van de Wetering M, Barker N, Stange DE, van Es JH, Abo A, Kujala P, Peters PJ, Clevers H. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 2009 May 14;459(7244):262-5.
- Boj SF, Hwang CI, Baker LA, Chio II, Engle DD, Corbo V, Jager M, Ponz-Sarvise M, Tiriac H, Spector MS, Gracanin A, Oni T, Yu KH, van Boxtel R, Huch M, Rivera KD, Wilson JP, Feigin ME, Ohlund D, Handly-Santana A, Ardito-Abraham CM, Ludwig M, Elyada E, Alagesan B, Biffi G, Yordanov GN, Delcuze B, Creighton B, Wright K,Park Y, Morsink FH, Molenaar IQ, Borel Rinkes IH, Cuppen E, Hao Y, Jin Y, Nijman IJ, Iacobuzio-Donahue C, Leach SD, Pappin DJ, Hammell M, Klimstra DS, Basturk O,Hruban RH, Offerhaus GJ, Vries RG, Clevers H, Tuveson DA. Organoid models of human and mouse ductal pancreatic cancer. Cell. 2015 Jan 15;160(1-2):324-38.
- Huch M, Dorrell C, Boj SF, van Es JH, Li VS, van de Wetering M, Sato T, Hamer K, Sasaki N, Finegold MJ, Haft A, Vries RG, Grompe M, Clevers H. In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature. 2013 Feb 14;494(7436):247-50.
- Hu H, Gehart H, Artegiani B, LOpez-Iglesias C, Dekkers F, Basak O, van Es J,Chuva de Sousa Lopes SM, Begthel H, Korving J, van den Born M, Zou C, Quirk C, Chiriboga L, Rice CM, Ma S, Rios A, Peters PJ, de Jong YP, Clevers H. Long-Term Expansion of Functional Mouse and Human Hepatocytes as 3D Organoids. Cell. 2018 Nov 29;175(6):1591-1606.
- Sato T, Stange DE, Ferrante M, Vries RG, Van Es JH, Van den Brink S, Van Houdt WJ, Pronk A, Van Gorp J, Siersema PD, Clevers H. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 2011 Nov;141(5):1762-72.
- Yui S, Nakamura T, Sato T, Nemoto Y, Mizutani T, Zheng X, Ichinose S, Nagaishi T, Okamoto R, Tsuchiya K, Clevers H, Watanabe M. Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5? stem cell. Nat Med. 2012 Mar 11;18(4):618-23.
- Yui S, Azzolin L, Maimets M, Pedersen MT, Fordham RP, Hansen SL, Larsen HL, Guiu J, Alves MRP, Rundsten CF, Johansen JV, Li Y, Madsen CD, Nakamura T, Watanabe M, Nielsen OH, Schweiger PJ, Piccolo S, Jensen KB. YAP/TAZ-Dependent Reprogramming of Colonic Epithelium Links ECM Remodeling to Tissue Regeneration. Cell Stem Cell. 2018 Jan 4;22(1):35-49.e7.
- Nanki K, Toshimitsu K, Takano A, Fujii M, Shimokawa M, Ohta Y, Matano M, Seino T, Nishikori S, Ishikawa K, Kawasaki K, Togasaki K, Takahashi S, Sukawa Y, Ishida H, Sugimoto S, Kawakubo H, Kim J, Kitagawa Y, Sekine S, Koo BK, Kanai T, Sato T. Divergent Routes toward Wnt and R-spondin Niche Independency during Human Gastric Carcinogenesis. Cell. 2018 Aug 9;174(4):856-869.e17.
- Watson CL, Mahe MM, Munera J, Howell JC, Sundaram N, Poling HM, Schweitzer JI,Vallance JE, Mayhew CN, Sun Y, Grabowski G, Finkbeiner SR, Spence JR, Shroyer NF,Wells JM, Helmrath MA. An in vivo model of human small intestine using pluripotent stem cells. Nat Med. 2014 Nov;20(11):1310-4.
- Uchida H, Machida M, Miura T, Kawasaki T, Okazaki T, Sasaki K, Sakamoto S, Ohuchi N, Kasahara M, Umezawa A, Akutsu H. A xenogeneic-free system generating functional human gut organoids from pluripotent stem cells. JCI Insight. 2017 Jan 12;2(1):e86492.
- Takebe T, Wells JM, Helmrath MA, Zorn AM. Organoid Center Strategies for Accelerating Clinical Translation. Cell Stem Cell. 2018 Jun 1;22(6):806-809.
- Okamoto R, Watanabe M. Investigating cell therapy for inflammatory bowel disease. Expert Opin Biol Ther. 2016 Aug;16(8):1015-23.
表. 由来となる細胞によるオルガノイドの比較
| 多能性幹細胞由来 オルガノイド | 体性幹細胞由来 オルガノイド | |
|---|---|---|
| 由来細胞 | iPS細胞・ES細胞 | 組織幹細胞 |
| 目的臓器・細胞への分化誘導 | 必要 | 不要 |
| 未成熟細胞の残存 | 可能性あり | 無し |
| オルガノイドを構成する細胞腫 | 単一〜複数 | 単一 |
| 臨床検体(生検等)からの樹立 | iPS細胞等を経ることが必要 | 直接樹立が可能 |
生体が持つ天然のデリバリーシステムであるエクソソームに学ぶ
東京医科大学 医学総合研究所
分子細胞治療研究部門
落谷 孝広
寄稿日(2019年3月)
- はじめに
エクソソームによって運ばれるマイクロRNAが、細胞間のコミュニケーションツールとして機能している、2007年に報じられたこのひとつのエクソソーム論文が世界中の研究者たちを震撼させてからもう10年が経とうとしている。細胞が本来備えているストレス応答機構に見られるように、生体に負荷される外部からの様々なシグナルは、細胞の形態変化といった単純な細胞応答のみならず、ゲノム・エピゲノム変動をベースにしたよりダイナミックな防御態勢の構築へと細胞を導く結果となる。近年、急速に研究が加速している細胞外小胞(EV:通称 ”エクソソーム”)もおそらくそうした細胞が必要とする応答機構の一つとして発達してきたと考えることができる。特に「がん」を考えた場合、その初期の発生の過程から浸潤、転移と行った進展に至るまで、様々な形で周囲のがん微小環境を構成する細胞群からの監視と攻撃を受ける異端児の「がん」細胞にとっては、エクソソームという新たな武器を手に入れたことで、容易に相手の攻撃をかわすことが可能となり、がん細胞の生存にとってより有利な微小環境を整えることに成功したのである。まさにがんの転移において、エクソソームは要の役割を果たしている。こうした生体が有する天然の細胞間情報デリバリーシステムであるエクソソームに多くを学ぶことで、医学生物学はもちろん、再生医療を始め様々な分野の新しい研究の起点となることが期待されている。
- エクソソーム研究の歴史を振り返る
エクソソームの発見は意外と古く、30年以上前にさかのぼる。1981年、2つのグループによりほぼ同時に、網状赤血球の研究で発見されたのが最初であるが1,2)、前立腺液中に含まれる細胞外小胞がプロスタソームという名称がついているのはあまり知られていない。「エクソソーム」という名称は少し遅れて1987年に命名された 3)。長らくエクソソームは、細胞にとって不要な物質を廃棄するための「ごみ箱」だと考えられてきた。しかし、1996年の、B細胞由来のエクソソーム表面に抗原が提示され、T細胞の活性化に関わるという報告 4) や、2007年のスウェーデンのLötvall博士のグループによる、miRNAがエクソソーム中に存在し、細胞間で受け渡しされるという報告 5) で、細胞間の情報交換にエクソソームが使用される可能性が示され、エクソソームに一気に注目が集まった。表1を参照されたい。2011年に第2回目の国際会議がパリで開催された。このときは第一回のときとは対照的に、用意した会場には収まりきれないほどの研究者が世界中から集結し、その会議に参加した研究者はまさに新しい歴史が始まる瞬間を共有したのであった。翌2012年にはLötvall博士らが中心となってエクソソームの国際ソサイエィティーであるISEV(International Society for Extracellular Vesicles: https://www.isev.org/)が発足したのである。我が国でも2014年にJSEV(日本細胞外小胞研究会)が設立され、多くの若手の研究者が集う活気のある会となっている。さらに2019年の4月にはISEVが初めてアジアで開催されることになったが、それが我が国、京都である。ぜひこの機会を生かして、日本の多くの研究者がエクソソームに興味を持っていただきたい。
- エクソソームの基礎
エクソソームとは、あらゆる細胞から分泌される直径100ナノメーター前後の小胞体であり、脂質二重膜で囲まれたその内部には、mRNA, microRNA, タンパク質等の多くの情報伝達物質が内包されている 6)。この小胞は、エンドゾームをオリジンとする機構で細胞外に放出されるが、これより少し大型の小胞であり、細胞膜がちぎれる形で放出された場合、マイクロベシクルというまた別の名称が付与されている。エクソソームは、直接細胞膜から形成されるのではなく、細胞内で形成されてから細胞外に分泌される。エクソソームは細胞質から初期エンドソームの内側に出芽するように形成され,その形成にはESCRT(endosomal sorting complex required for transport)やテトラスパニンが関与すると考えられている。エクソソームを多数含むエンドソームは、その形状からMultivesicular body (MVB)と呼ばれる。エクソソームの膜を構成する脂質はセラミドやスフィンゴミエリン、コレステロールなどが多く、脂質ラフトと類似していることから、MVBの脂質ラフトのような領域から形成されると考えられる。実際、セラミドの合成酵素であるnSMase2を過剰発現すると、エクソソームの分泌量が上昇することは既に小坂らが証明済みである 7)。MVBには、リソソームや細胞膜に融合する性質があり、複数のRABタンパク質に制御されている。細胞膜に融合した場合のみエクソソームは細胞外へ分泌される。細胞膜との融合はSNAREタンパク質の作用である。
エクソソームと受容する側の細胞への接着には、テトラスパニンが関わると考えられている。エクソソームの細胞への取り込みの際は、様々なエンドサイトーシス経路を通る可能性が示されている。それらはクラスリン依存的、非依存的な経路、カベオリンを介した取込み、マクロピノサイトーシス、ファゴサイトーシス、脂質ラフトを介した取込み、などである 8)。また、直接細胞膜に結合する形で取り込まれた場合、エクソソームは微小管で核周辺に輸送される 9)。エクソソーム内包物はエンドソームに融合することで放出される 8)が、タンパク質はリソソームに取り込まれ、その膜部分は細胞表面に戻されるという観察もある 9)。
細胞外小胞にはエクソソームの他に、アポトーシス小体、マイクロベシクルが知られている。現在、3種の細胞外小胞の回収は超遠心法が主流だが、それぞれの細胞外小胞を完全に分離することは不可能である。加えて、分泌する細胞によっても性質が異なるため、エクソソームの明確な定義は現在でも困難である 10)。現状では「エクソソーム」が意味するものは論文間で相違があるので、論文を読む際には論文内の定義や分離方法に注意を払う必要がある。
細胞内の物質が選択的にエクソソームに内包されるかは興味深い問題である。エクソソームに内包される物質の割合は、ある程度細胞内の存在量を反映するようだ。細胞内に過剰発現させたmiRNAやタンパク質、mRNAはより多くエクソソームに内包されることは既に多くの論文で示されている。一方で、選択的に取り込まれるとする報告例もある。例えば、rRNAは細胞内のRNAの大部分を占めるにも関わらず、エクソソーム中にはほとんどrRNAが検出されない。また、乳がん細胞MCF-7において、細胞内で最も量の多いmiR-720のエクソソーム中での割合はわずか2%で、より細胞内の存在量が少ないmiR-451やmiR-107のほうが高濃度で存在した 11)。しかし、実際にエクソソームに特異的にmiRNAを内包する機構はまだ明らかになっていない。
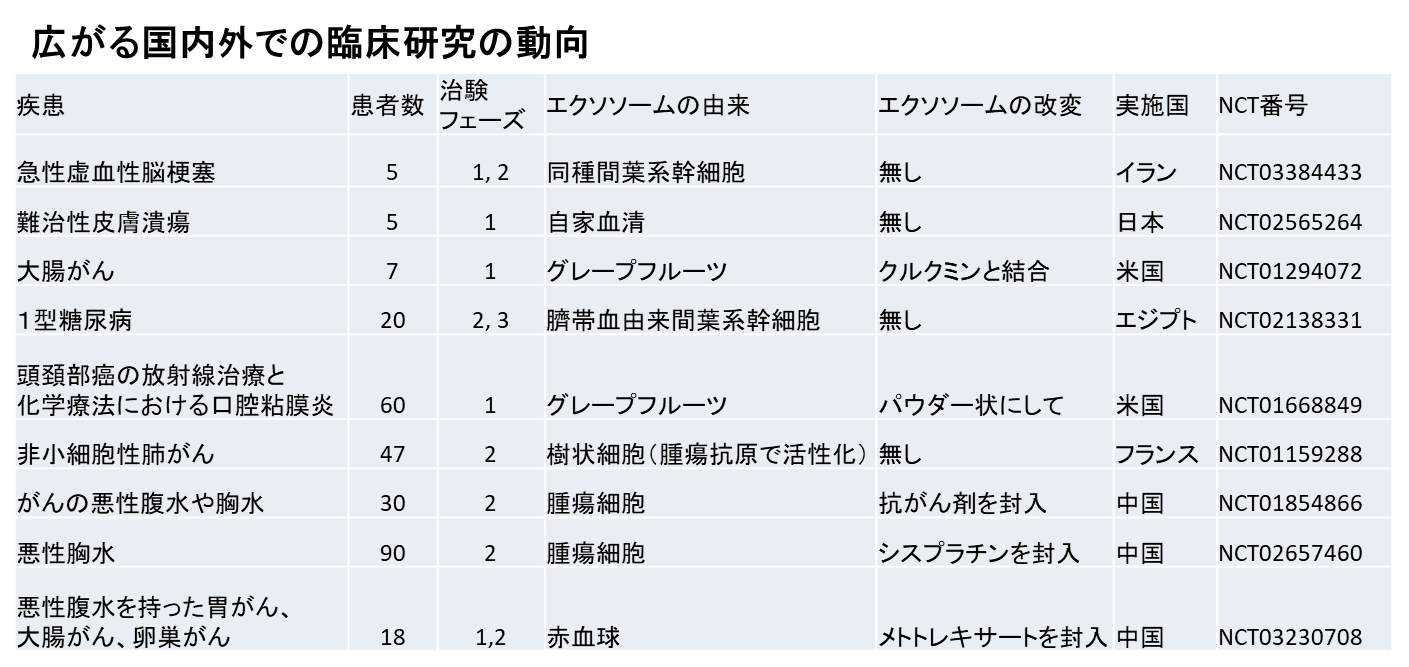
エクソソームの特定の細胞への運搬機構も、まだ解明されていない疑問の一つである。これまでに、T細胞から抗原提示細胞へ、エクソソームを介してmiRNAが一方向に輸送されるというものがあり、少なくとも特異的な輸送は存在するようである 12)。しかし、どの程度一般的かは定かではなく、また現状では特異性を決定する因子は特定されていない。現在は遺伝子組換えでエクソソーム表面にリガンドを提示し、受容体—リガンド相互作用を利用してエクソソームを特異的に運搬する研究が行われている 13)。もしエクソソームの特異的な輸送機構が解明されれば、エクソソームを応用したドラッグデリバリーシステム(DDS)が可能であり、すでに海外の製薬企業はアンチセンスDNAなどを封入したエクソソーム製品の臨床試験に参入している。- 再生医療とエクソソーム
診断・治療、創薬などの医学生物学分野におけるエクソソーム研究の重要性のみならず、エクソソーム研究の成果が生み出す社会実装への期待である。それはまず再生医療分野での医療応用である(図1)。世界的に観ると、オープンになっているだけで100件以上の前臨床試験(動物疾患モデルでの検証実験)が既に走っている。そして92件以上の臨床研究が米国、フランス、中国、日本、イランで行われており、その多くはヒトの間葉系幹細胞(骨髄、脂肪、臍帯由来)や植物に由来するエクソソームであり、対象疾患は「がん」、「慢性疾患」、「難治性疾患」、「心疾患」、「炎症性疾患」等が中心である(表1にその一部の例を示す)。細胞治療を凌駕するセルフリーセラピーの代表としてエクソソームの有用性を示す多くのデータがこの数年間で急速に得られたことによるものと推測される。次に期待されるエクソソーム研究が拓く新しい応用分野は、食品、化粧品分野である。フルーツや野菜に含まれるエクソソームあるいはエクソソーム様細胞外小胞はすでにその有用性が証明され(抗炎症作用等)、開発が進んでる状況が世界中で広告されている。またエクソソームの持つ皮膚の老化に関するメカニズムを利用した化粧品が欧州大手化粧品メーカーで商品化される等、スキンケアに関する分野での需要も爆発的な広がりをみせている。現在、既に開発が進んでいるエクソソームの診断・治療分野での市場予測が2018年の推計2500万ドルから2025年には3億5000万ドルへと伸長が予測されているが、もしそこにこうした食品、化粧品分野での製品化競争が加わると、市場はもっと大きく伸びる可能性もある。
しかしその反面、エクソソーム研究の課題は山積みだ。現在、世界中の研究者が苦慮しているのは、エクソソームあるいはEVsの不均質性(heterogeneity)である。この課題をどう克服し、研究と応用化を進めるかは、エクソソーム製品の規格化を行う上では欠かせない課題である。そしてこの規格化を担うエクソソーム解析装置の技術開発も世界的な競争になっている。そしてセルフルーセラピーには欠かせない、数千リットルの大容量の培養液からエクソソームを含む高度な再生医療能力を持つ製剤を精製するシステムの構築だ。こうした各方面での技術革新がない限り、エクソソームに寄る未病社会の実現はあり得ない。いまこそ多くの叡智を結集して、この古くて新しい細胞の持つ天然のデリバリーシステムを人々の幸福に生かせるよう産官学、あらゆる方面の方々のご支援を願っている。
- 文献
-
- C. Harding, J. Heuser, P. Stahl, Receptor-mediated endocytosis of transferrin and recycling of the transferrin receptor in rat reticulocytes. J. Cell Biol. 97, 329-339 (1983).
- B. T. Pan, R. M. Johnstone, Fate of the transferrin receptor during maturation of sheep reticulocytes in vitro: selective externalization of the receptor. Cell 33, 967-978 (1983).
- R. M. Johnstone, M. Adam, J. R. Hammond, L. Orr, C. Turbide, Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). J. Biol. Chem. 262, 9412-9420 (1987).
- G. Raposo et al., B lymphocytes secrete antigen-presenting vesicles. J. Exp. Med. 183, 1161-1172 (1996).
- H. Valadi et al., Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat. Cell Biol. 9, 654-659 (2007).
- N. Kosaka N, H. Iguchi, T. Ochiya. Circulating microRNA in body fluid: a new potential biomarker for cancer diagnosis and prognosis. Cancer Sci. 101(10): 2087-2092 (2010).
- N. Kosaka et al., Neutral sphingomyelinase 2 (nSMase2)-dependent exosomal transfer of angiogenic microRNAs regulate cancer cell metastasis. The Journal of biological chemistry 288, 10849-10859 (2013).
- L. A. Mulcahy, R. C. Pink, D. R. Carter, Routes and mechanisms of extracellular vesicle uptake. Journal of extracellular vesicles 3, (2014).
- T. Tian, Y. Wang, H. Wang, Z. Zhu, Z. Xiao, Visualizing of the cellular uptake and intracellular trafficking of exosomes by live-cell microscopy. J. Cell. Biochem. 111, 488-496 (2010).
- S. J. Gould, G. Raposo, As we wait: coping with an imperfect nomenclature for extracellular vesicles. Journal of extracellular vesicles 2, (2013).
- L. Pigati et al., Selective release of microRNA species from normal and malignant mammary epithelial cells. PLoS One 5, e13515 (2010).
- M. Mittelbrunn et al., Unidirectional transfer of microRNA-loaded exosomes from T cells to antigen-presenting cells. Nature communications 2, 282 (2011).
- S.-i. Ohno et al., Systemically injected exosomes targeted to EGFR deliver antitumor microRNA to breast cancer cells. Molecular therapy : the journal of the American Society of Gene Therapy 21, 185-191 (2013).
エクソソームの技術面でのposition paperが国際細胞外小胞協会のオフィシャルジャーナルであるJEVから出版されているので参照されたい:Théry C, et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 2018 Nov 23;7(1):1535750. doi: 10.1080/20013078.2018.1535750. eCollection 2018.
-
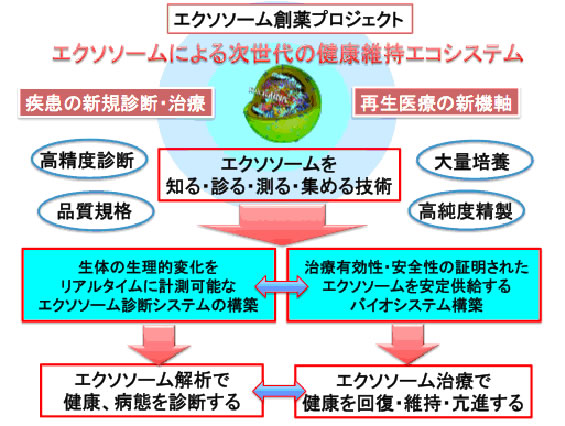
図1 エクソソームと創薬
エクソソームは次世代の健康維持エコシステムの構築に寄与する。特に間葉系幹細胞や組織幹細胞などのエクソソーム成分は今後の再生医療分野において大きな効力を発揮する。
-
表 広がる国内外でのエクソソームの臨床研究
これはその一部だが、すでに多くのグループがエクソソームを主体にした再生医療の臨床研究を進めている。
再生医療を支える培養技術の貢献
大阪大学大学院工学研究科
紀ノ岡 正博
寄稿日(2019年3月)
再生医療は,医療を「受ける人(患者)」,医療を「施す人」,そして「応援する人(ボランティア)」からなる支える人と技術の結集により実現され,医療を「施す人」は,再生医療技術を開発する「創る人」,医師等の治療する「行う人」,さらには,病院や細胞製造企業において細胞を調製する「支える人」,そして,種々の規則を「見守る人」が挙げられます.これらの人が,細胞加工を経るなどの複雑で多様な治療に対し,「受ける人」の利益を導くための努力を惜しみなく提供することで再生医療は実現できるものと思います.本格的かつ汎用的医療としての再生医療の実現には,医師側の治療開発だけではなく,細胞製造設計や治療を患者に安定供給を実現するための技術開発「モノづくり」,その技術を活用できるための規制や国際標準の策定「ルールづくり」,これらの仕組みを活かすための人材育成「ヒトづくり」が必要で,社会全体で同時に進める「コトづくり(社会システムの構築)」が不可欠だと思います.特に,細胞を含む移植材料(細胞加工物)の調製には,細胞単離,増幅,分化誘導,形成加工などの一貫した工程を企業等の細胞培養加工施設にて実施するだけではなく,病院内での細胞・組織採取や移植材の洗浄などの院内調製を含む工程があり,施設を超えた一貫した調製工程が重要となり,これまでに経験のない方法であります.
細胞培養加工は,無菌性が担保された移植細胞の確保が目的となり,無菌環境での操作(無菌操作)と細胞品質を確保できる操作(培養手技)により細胞加工物を安定して調製できます.細胞製造のための系(システム)を考えると,図1に示すように,系は,工程(プロセス;加工,反応,形成などを含む)と,そこへの入力(細胞,原材料,資材など)と出力(移植材である細胞加工物など)から成ります.工程の安定性を損なう変動としては,①外界から系に対する外乱(無菌環境など)由来の変動,②入力である細胞・原材料・資材由来の変動が挙げられます.さらに,細胞を用いた製造において固有で無視できない変動として,③工程の中で生じる「内なる乱れ」由来の変動(培養操作における動作の差異による細胞自身に起因する乱れ)が挙げられ,細胞特性および工程の連続性により内なる乱れが増大・累積し,不安定性が増大することがあります.ここで,細胞は不確定要素が多く,自ら細胞イベントを引き起こし逐次に状態が変化し(時間依存性),シグナル開始から表現型を提示するまでに時間がかかること(時間遅発性)などの特徴を有しており,内なる乱れが引き起こされ,得られる細胞群が不均質,かつロット間に変動が生じると考えられます.
従来の医薬品等の製品に対する製造概念として,「製造における種々の変動を考慮する際の製造設計の容易性」を意味する「製造性」(manufacturability, 製造可能性)が挙げられ,この概念に基づき製造プロセスの構築がなされてきました.しかし,細胞加工物の製造の安定性を目指すうえで,上述の内なる乱れを考慮する必要があり,細胞製造においては,固有の概念構築が要求されます.そこで,「細胞を用いた製造における種々の変動を考慮する際の製造設計の容易性」を細胞製造性(cell manufacturability)とし,出力における細胞加工物の品質安定化,工程の高効率化,低コスト化などを考慮し,製造の最適化を行うことが重要となります.特に,操作者による動作教育や動作の機械化が無菌環境の維持や培養手技の安定性を導き,外乱や内なる乱れを低減させ,移植材の品質が安定すると考え,解決に向けた技術が開発されてきました.
これまで我々は,図2に示すような,アイソレータ技術を活用した自動細胞製造装置を設計し,iPS細胞由来の網膜色素上皮細胞の生産に対する一貫製造に成功しました(動画サイト参照).本製造は,約4か月間の長期かつ脆い重層化構造の分化誘導を経た培養工程を有し,無菌環境の堅牢性と柔らかい動作が不可欠となります.これまで,安全キャビネットを利用した培養においては,無菌操作や培養手技のエキスパート育成が長期間必要とし,結果として,細胞調製の失敗率の増大,教育コストの増加,操作者の安定雇用など種々の問題が存在しました.そこで,無菌環境の維持にはアイソレータシステムにて堅牢性を確保し,培養手技には,加速度センサー付き培養容器を設計し,操作者や機械の動作に対する定量化,スムーズな動作の確定,機械動作の最適化,動作安定に伴う工程の定常化を導き出し,最終的に,網膜色素上皮細胞の細胞品質の安定を実現しました.また,本自動化により,人手による製造と比べ失敗率も低減できコスト削減にも貢献しました.
より高度な移植材を利用した再生医療の実現には,必要な細胞調製技術を開発しつつ,患者により早く,安全に,効率よく治療を提供できることが不可欠であります.特に,治療設計から移植材の特性と調製方法を理解した工学者と連携することが要であり,調製技術の開発が,移植材品質の安定化を得,治療成績の安定性やコスト削減を導き,広く活用される医療技術となるものと思われます.
-
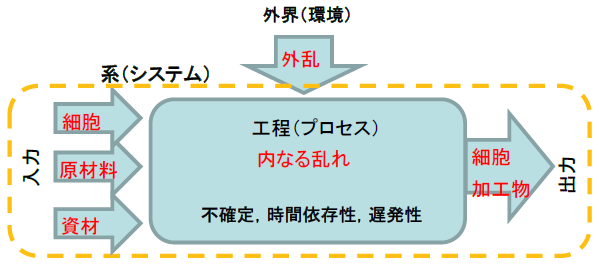
図1 細胞製造における系の考え方
-

図2 アイソレータ技術を活用した自動細胞製造システム
(左図;装置全容,右図;装置内部)
脱細胞化臓器骨格技術
慶應義塾大学 医学部外科学(一般・消化器)
八木 洋
寄稿日(2019年3月)
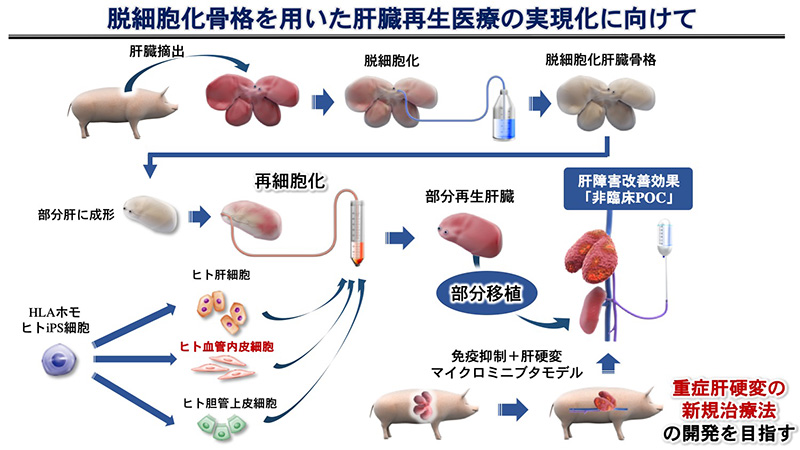
再生医療に求められる究極の目標である「臓器再生」を実現させるために、我々は「脱細胞化」技術を用いた研究を進めています。生体組織・臓器からすべての細胞を洗浄・除去して主に細胞外マトリックスから成る骨格だけを残し、再生医療の研究に利用するこの技術と初めて出会ったのが10年前の米国留学の時でした。そこで脱細胞化によって透明化した肝臓に衝撃を受け、以来これまで本研究開発一本に集中して取り組んで参りました。
本技術の際立った特徴は、再生医療の三要素である「細胞」・「生理活性物質」・「足場」のうち、生体内の構造に限りなく近い「究極の足場」を提供できる点と、汎用性が高く様々な組織・臓器に容易に適応可能な点です。脱細胞化後には一部生理活性物質も残存していることが示されていますが、その機能については明らかになっておりません。ただし少なくとも細胞機能に影響を与える因子が少なからず残存している可能性が示唆されており、これらの因子と臓器特異的な立体構造を保つ性質によって、組織を構成する種々の異なる細胞が、体外であっても体内であっても本来あるべき骨格内部の局所に選択的に遊走・生着することが観察されています。また特に本技術が持つ他に類を見ない特徴として、臓器内部の脈管構造がマイクロ単位の微細なものから、臓器外部に位置するミリ・センチ単位の大型構造まで連続して残存していることです。脱細胞化後でも連続的な脈管構造を保持することで、体外でその脈管ルートから内部に細胞を播種することが可能である上、体外で細胞を生着させた臓器骨格構造を丸ごと血管吻合して移植できるため、研究開発技術と臨床応用との間に立ちはだかるスケールギャップを一気に埋めることが可能であると考えています。我々は本研究開発を推進するために、2012年に医学部外科学教室内に「再生医療班」という研究グループを立ち上げ、若い獣医師を積極的にチームのメンバーに入れてこの技術を逸早く大動物モデルに応用し、大型の部分再生肝臓を作製してブタを使った移植実験を重ねて参りました。免疫抑制剤の最適化・移植後内部血流の均等な維持など、実臨床のためにはまだ超えなければならないハードルがありますが、AMEDの支援を受けてこれまでにブタ新鮮肝細胞と血管内皮細胞を用いた移植実験を成功させ、これからまさにヒトiPS細胞由来の肝臓構成細胞を生着させた臓器骨格の移植実験を開始する段階に入っております。
また平行してこの「脱細胞化骨格」自体を無細胞の状態で臓器の部分切除断面に接着させると体内で臓器再生を惹起する効果が、特に腎臓で非常に強く認められたため、脱細胞化によって得られた骨格自体が医療材料としての有効性を持つ可能性が示唆されます。我々はこの新しい生体材料を臓器再生医療の基盤技術として実用化するために、Jkic(JSR・慶應義塾大学医学化学イノベーションセンター)と東京都のAMDAPの支援の元で、2019年1月に大学発ベンチャー企業を創業いたしました。今後このベンチャー企業を起点として、臨床医の立場で研究開発から実際の移植・術後経過・治療後評価まで一貫して責任を持った製品開発を行い、近い将来不全臓器に取って代わる臓器再生医療の実現化を目指して一歩一歩積み重ねていきたいと考えております。
東京医科歯科大学消化器内科・上皮研究分野の紹介
東京医科歯科大学消化器内科
油井 史郎
寄稿日(2019年3月)

私たち東京医科歯科大学消化器内科・上皮研究分野の紹介をさせて頂きます。私たちは腸上皮オルガノイドの培養技術開発や、再生医療研究への応用に取り組んでいます。オルガノイドというのは、2000年半ば頃より開発が進んできた新しい技術です。細胞を細胞外基質に埋め込んで培養すると、細胞の集合体が立体的な形をとるようになりますが、その沢山の細胞で構成される3次元構造体をオルガノイドと言います。実は、オルガノイドの研究は、日本人が世界をリードしている領域で、かつ消化器オルガノイドの研究は、いろいろな臓器のオルガノイド技術の発展を先導してきたモデル領域でもあり、とても活発な研究開発が進んでいる面白い分野です。
私たちは、オルガノイド開発の黎明期に、独自のオルガノイドを開発し、オルガノイドを移植することでマウスの腸炎の潰瘍を治すことができるという世界で初めての成果を報告しました 1)。オルガノイドは生きた絆創膏で、潰瘍を被覆して、より早く治すことに貢献します。細胞ですので、周囲環境をリモデリングしたり、色々な物質を産生したりします。このような高い能動性が特徴だと思います。この基礎研究は今、日本医療開発研究機構(AMED)、再生医療実現ネットワークプログラム、疾患組織別実用化研究拠点(拠点B)の支援のもとに進めている、世界初のヒトの潰瘍性大腸炎に対するオルガノイド治療という新しい治療法の開発の基礎になっています 2)。
私たちが開発したオルガノイドには面白い特徴があります。それはコラーゲンを使用することによってもたらされる性質です。コラーゲンといえば、化粧水の宣伝などを通じて、健康的なイメージがありませんか?そのコラーゲンに腸の上皮細胞を埋め込んで培養すると面白いことが起こるのです。それは上皮細胞の胎児返りです。真面目な科学の話として、コラーゲンは若返りと関係があることが解ってきました 3)。現在、日本医療開発研究機構(AMED)、再生医療実現ネットワークプログラム、幹細胞・再生医学イノベーション創出プログラムの支援で、治療にもっと有効でより安全な細胞の開発に取り組んでいます 2)。
消化器内科の先生は、炎症性腸疾患などで腸に潰瘍性病変があるときに、発赤調の上皮が潰瘍をせっせと治している、とても不思議な現象を見たことがあると思います。私は、市中病院で消化器の臨床に携わっている頃に、消化管の臓器は目に見えて再生するすごい臓器だと思いました。私は消化器内科の前に、数年間神経疾患の臨床に携わっていましたので、神経組織と比べたときの消化管の再生能力を、実に新鮮に感じたのです。病理学では再生上皮と言いますが、この上皮がどうやって出現するか、ご存知でしょうか?要するに、どうやって潰瘍が治るか、ご存知でしょうか?その仕組みを理解することは、潰瘍という病態を理解し、治らない難治性潰瘍の病因を解明する上で重要になります。上皮機能の研究は、炎症性腸疾患研究には欠かせないテーマの一つです。
医学研究は医療開発の礎です。日本の消化器の再生医療研究・基礎研究開発を世界に発信してきた東京医科歯科大学消化器内科・上皮研究分野で、ぜひ私たちと一緒に、未来の医療をもっと良くするための研究をしてみませんか?
- 文献
-
- Yui S, Nakamura T, Watanabe M et al, Nature Medicine, 2012
- https://www.amed.go.jp/program/list/01/02/001.html
- Yui S, Watanabe M, Jensen K et al, Cell Stem Cell, 2018
ヒューマン・オルガノイド研究の可能性
東京医科歯科大学 統合研究機構 先端医歯工学創成研究部門
武部 貴則
寄稿日(2019年12月)
- はじめに
近年、ヒューマン・オルガノイドと呼ばれる体内に存在する器官構造を持った三次元組織体を、ヒト組織幹細胞や多能性幹細胞(Pluripotent Stem Cell: PSC)から創出する研究に注目が集まっている。すなわち、発生や再生過程における器官形成・修復過程で生じる現象を試験管内で人為的に再現することで、幹細胞を器官特異的なオルガノイドへの誘導を試みる事例がさまざまな臓器に関して報告が相次いでいる。特にヒト幹細胞より創出されたヒューマン・オルガノイドは、試験管内で人間の生理的な構造や機能を模倣するツールとして扱えることから、発生生物学から病態生理学、さらには臨床試験前の創薬研究に至るまで幅広い分野で注目を集めている。そこで本稿では、急速な進歩を遂げつつあるヒューマン・オルガノイドに関しての最新研究成果を、われわれのグループの事例を含めて解説していく。
- 次世代のオルガノイド研究
ヒューマン・オルガノイド創出を目指す医学研究においては、組織幹細胞(Adult Stem Cell: ASC)やPSCのいずれかを細胞ソースとすることが多い。特に、後者のPSCを活用したケースにおいては、着床後に生じる三胚葉形成に始まる発生生物学的なプロセスを手本としながら、オルガノイドの段階的な設計プロトコルがデザインされることが多い。すなわち、胎児期における器官発生過程で生じる緻密な分子・細胞間相互作用を人為的に再現することで、本来細胞が有している自発的に器官を形成しようとする能力である自己組織化(Self-organization)の制御を通じて、オルガノイドの創出が試みられている。すでに、内胚葉からは胃や腸、肺、肝臓、中胚葉からは腎臓、外胚葉からは脳皮質や下垂体、眼胚などというように、およそ体内に存在する臓器の多くについてはヒューマン・オルガノイド形成が報告されている1)。
当研究室においては、内胚葉より肝胆膵領域を中心に、ヒトiPS細胞を始めとしたPSCからさまざまな方法でヒューマン・オルガノイドが創出可能であることを報告してきた。特に、これまで報告されているオルガノイドの多くは、上皮細胞などある特定の単一細胞種が極性化したものが主であったが、われわれのグループでは、より複雑性を持たせた「次世代のオルガノイド」を形成しようと様々なモデリングを試みている。-多細胞系オルガノイド
正常器官発生過程においては、臓器の主たる構成成分となる実質細胞に加えて、適時・適所・適量な支持細胞、たとえば、血管やリンパ管、神経、間質細胞、免疫細胞といった多様な細胞種が侵入・構造化することが知られている。我々は、このような過程を模倣するべく、まず肝臓分野でオルガノイドの複雑化を試みてきた。
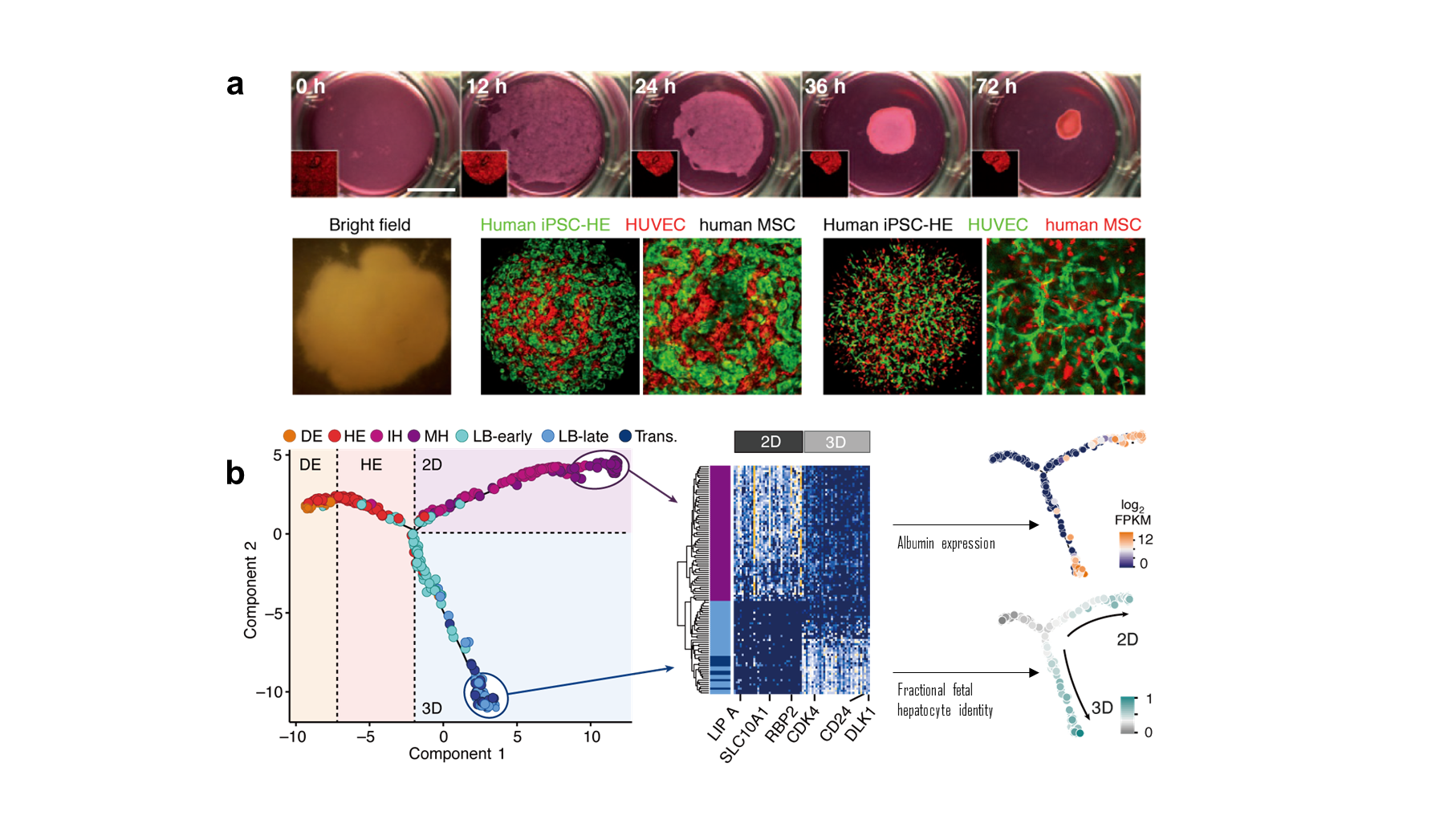
肝臓の初期発生段階においては、将来の血管や横隔膜を生み出す血管内皮前駆細胞と間葉系前駆細胞との緻密な相互作用を経ることで、腹側前腸内胚葉細胞の出芽(Budding)とよばれる特徴的な形態形成が誘導され、肝芽(Liver bud)とよばれる臓器の原基を形成することが知られている。そこで、われわれは、ヒトiPS細胞由来の肝内胚葉細胞・間葉系細胞・血管内皮細胞を至適な支持体上で共培養することにより人為的に出芽様の形態形成を誘導できることを報告し、さらには、肝芽オルガノイド内に原始的な血管網が形成されることを報告した2)(図1-a)。また、シングルセルRNAシーケンス解析を用いることで肝細胞の分化・成熟に重要な遺伝子群の経時的な発現パターンを確認することができただけでなく、ヒト肝芽オルガノイドにおいては、間葉系細胞を中心に供給される血管内皮細胞増殖因子(VEGF)シグナルを介した細胞間相互作用によって肝芽細胞の分化が促進されるというユニークなメカニズムが記述された3)(図1-b)。これまで、ヒトを対象とした発生現象の理解は極めて限定的であったが、ヒューマン・オルガノイドを活用することで新たにヒトにおける生命現象に迫ることが可能であることを示した事例と考えられ、今後、さまざまなヒューマンバイオロジーへの貢献が期待される。
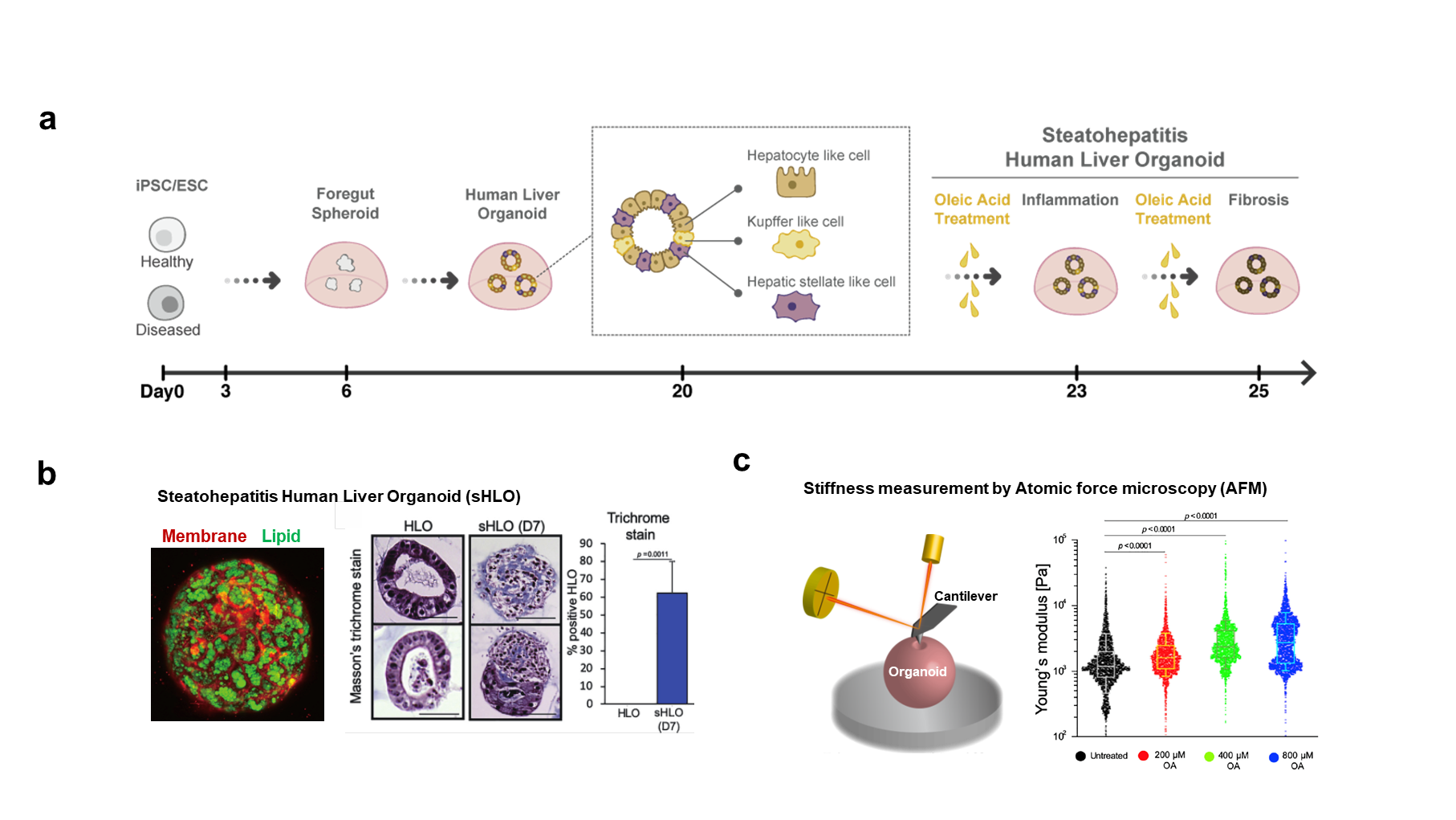
一方、このような多細胞系よりなるオルガノイドの作出には、単純系から複雑系への移行を同一の前駆細胞から同時に達成する「共分化」いう方法を用いることもできる。前述した共培養の方法とは異なり、分化の過程において可溶性因子や細胞外マトリックスを同一シャーレ内に添加することで、間質や免疫などの成分を含む多細胞系を一括誘導することもできる。たとえば、われわれの最近の研究では、肝臓の器官形成時に重要な役目を果たすレチノイン酸シグナルに着目し、オルガノイド形成初期にレチノイン酸を導入することで肝細胞に加えて炎症を惹起する肝臓常在性マクロファージであるクッパー細胞や線維化を誘導する肝星細胞の細胞群が、共分化できることを報告した4)(図2-a)。さらに、遊離脂肪酸であるオレイン酸を加えることで、肝臓オルガノイド内に中性脂肪(トリグリセリド)が顕著に蓄積し、繊維化を示す病理的変化や硬さ変化が生じることを報告している4)(図2-b)。このような共分化法を用いることで、同一培地においても多細胞系の長期維持が可能であることから、炎症・線維化など疾患表現型を獲得するまでに時間を要する慢性疾患のモデル、ひいては、創薬応用等への活用が大いに期待される技術と考えられる。-多臓器オルガノイド
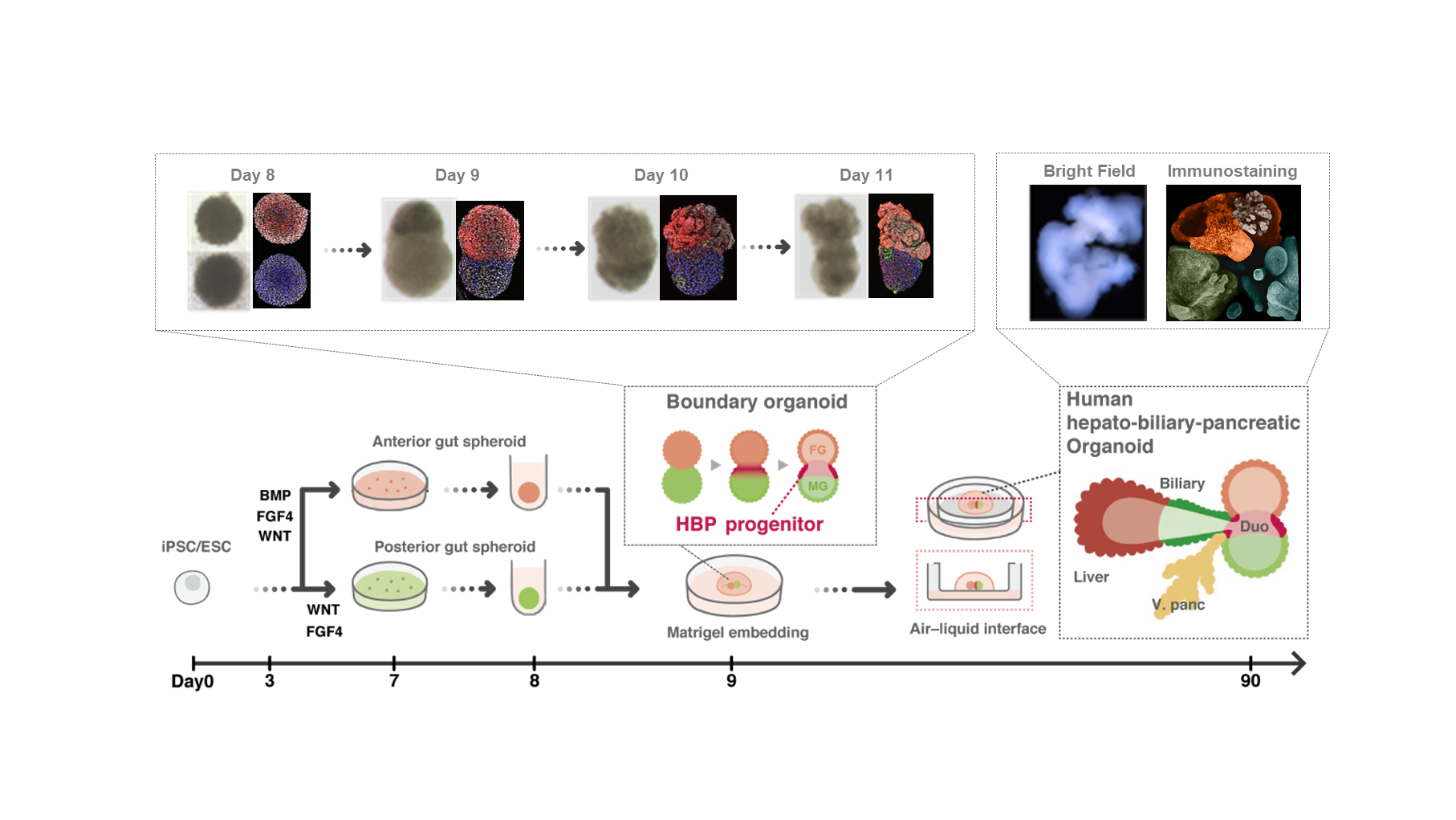
特定の臓器のみ(単一臓器)に焦点をあてオルガノイドの誘導を試みる従来のパラダイムでは、隣接した複数臓器間の連結を再現することは難しく、目的の臓器機能が充分に発揮されない、あるいは、持続しないといった重大な未解決課題が存在している。例えば、肝臓に隣接する臓器である「胆管」において狭窄が生じる胆道閉鎖症などの疾病では、徐々に肝臓が傷害され、最終的に肝不全の状態に陥ることが知られている。そこでわれわれは、臓器の完全再生を実現するためには臓器の設計思想の抜本的な見直しが必要と考えた。特に、周辺臓器との連続性を取り入れた複雑な多臓器創生技術の開発が急務であると考え、胎内における器官形成プロセスに立ち戻って多臓器発生・連結が確保される現象の再現を試みた。具体的には、受精後に形成される原始腸管を構成する前腸組織と中腸組織の境界領域から肝胆膵領域が発生することが知られていることから、この時期に生じる「境界領域」には自発的に肝胆膵への運命決定を推し進めるプログラムが存在すると考えた。実際に、ヒトiPS細胞から別々に誘導した前腸および中腸組織を連結させて前腸-中腸境界を人為的に形成することで、われわれは肝臓・胆管・膵臓の前駆細胞がその境界領域より自律的にパターンが誘導されることを見出した5)(図3)。このように、異なる組織間の境界面における組織間相互作用をうまくモデルすることで複雑かつ相互接続された組織を発達させることが可能となり、本技術を応用することで肝胆膵領域に留まらず例えば腎臓-尿管-膀胱といったその他の多臓器オルガノイドの実現が期待される。-デザイナー・オルガノイド
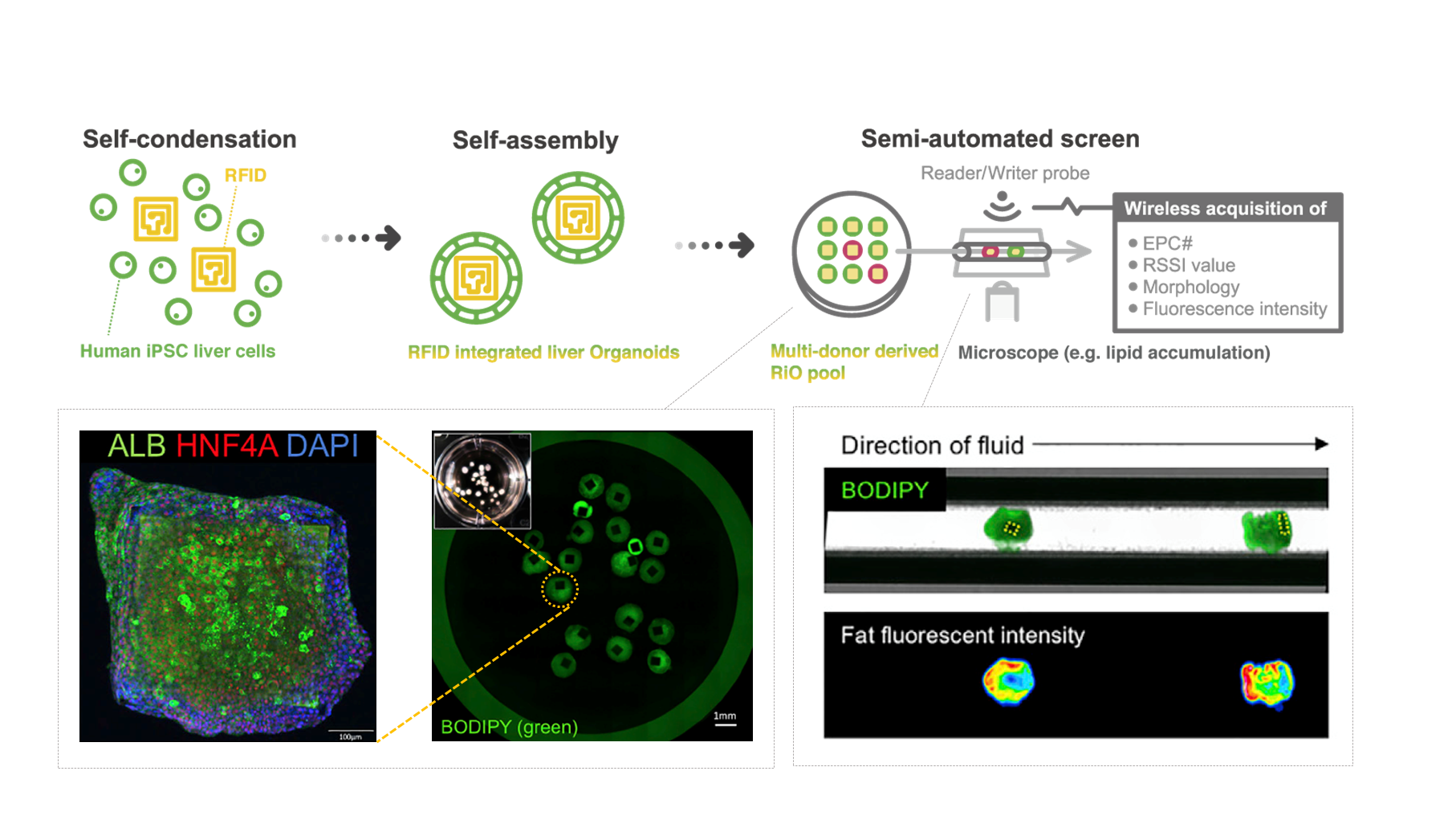
近年、プリンテッド・エレクトロニクスやマイクロフルイディクス等、集積回路等の電子部品や、ヘルスケア領域において極小なワイヤレス通信を可能とするデバイスなどの研究が盛んに進展を見せている。このような、超小型デバイスをオルガノイドに非侵襲的に付加することができれば、マイクロセンシングやアクチュエーションといった人工的な計測・制御系を組み込むことで全く新たなオルガノイド、いわば、デザイナー・オルガノイドともいうべき概念が実現できる可能性がある。そこで、われわれは、交通機関で利用されるカードやスーパーなどで商品管理に用いられている、RFID(Radio-Frequency IDentification)と呼ばれるID情報を埋め込んだRFタグから非接触で電波を用いて情報をやりとりする技術に注目し、オルガノイドにおける管腔形成過程において、内腔に超小型RFタグを取り込ませることで個々の組織をワイヤレス識別できる系を構築した6)(図4)。本技術はRFタグのみならず様々な極小デバイスの組み込みに活用可能であることから、将来的にさまざまなオルガノイドの機能拡張に有益なプラットフォーム技術となることが期待される。- おわりに
以上のようにさまざまな分野において、革命的ともいえる発展を遂げてきたオルガノイド研究であるが、以下に示すようにいまだ多くの未解決課題が残されている。
1. 自己組織化の原理: 分子・細胞レベルでの自己組織化メカニズム
2. 成熟化と維持: 概して未成熟な状態である器官機能の向上と維持
3. 支持成分の統合: 血管、神経、免疫などといった支持成分の統合
4. 遠隔器官間の相互作用: ペプチドやホルモン、エクソームなどを介した遠隔器官間の相互作用
5. 隣接器官間の連結: 周辺組織との構造的連続の人為再現
6. 再現性の確保: バッチ間・ウェル内におけるばらつきの低減
7. 品質保証の方法: 標的オルガノイドの定義
8. 生体組織との比較手法: 生体内組織との比較方法の一般化これらの課題解決を目指すためには、オルガノイド研究を支える科学的基盤に立ち返り、基礎研究を継続することが必須となる。発生・再生生物学や幹細胞生物学のみならず、免疫学、生理学、病理学、生化学、ひいては、数理・物理学などといったより統合的な科学的思考が重要と思われる。さらには、近年進歩の著しい工学的な視点を融合していくことで、その多くの重要課題解決への糸口が開けるものと期待されている。
- 文献
-
- Clevers, H. (2016). Modeling development and disease with organoids. Cell, 165(7), 1586-1597.
- Takebe, T., Sekine, K., Enomura, M., Koike, H., Kimura, M., Ogaeri, T., ... & Aoyama, S. (2013). Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature, 499(7459), 481-484.
- Camp, J. G., Sekine, K., Gerber, T., Loeffler-Wirth, H., Binder, H., Gac, M., ... & Belicova, L. (2017). Multilineage communication regulates human liver bud development from pluripotency. Nature, 546(7659), 533-538.
- Ouchi, R., Togo, S., Kimura, M., Shinozawa, T., Koido, M., Koike, H., ... & McCauley, H. A. (2019). Modeling Steatohepatitis in Humans with Pluripotent Stem Cell-Derived Organoids. Cell metabolism. 30(2), 374-384.e6.
- Koike, H., Iwasawa, K., Ouchi, R., Maezawa, M., Giesbrecht, K., Saiki, N., ... & Zorn, A. M. (2019). Modelling human hepato-biliary-pancreatic organogenesis from the foregut–midgut boundary. Nature, 574(7776), 112-116.
- Kimura, M., Azuma, M., Zhang, R. R., Thompson, W., Mayhew, C. N., & Takebe, T. (2018). Digitalized Human Organoid for Wireless Phenotyping. iScience, 4, 294-301.
-
図1:ヒトiPSCからの肝臓オルガノイド形成過程とその多細胞メカニズム
(a)ヒトiPSC由来内胚葉細胞、ヒト血管内皮細胞,ヒト間葉系細胞を共培養することにより、血管内皮細胞による網目状の管状構造体を包含した直径数mmの肝臓オルガノイド が自律的に形成される。(文献2より引用・改編)
(b)肝臓オルガノイド形成過程における細胞分化経路や遺伝子発現変化。シングルセル解析と主成分分析によって得られた第一主成分(横軸)には主に肝細胞としての成熟度の違いが、第二主成分(縦軸)には主に培養方法の違い(平面培養と三次元培養)が反映されている。培養法の違いにより発現が異なる遺伝子が確認された一方で、アルブミンなど肝細胞の分化・成熟に重要な遺伝子群の経時的な発現パターンは共通してみられる。また、肝臓オルガノイドを形成する肝細胞は、平面培養で分化誘導した肝細胞に比べて胎児肝細胞とより高い相関を持つ傾向にある。(文献3より引用・改編) -
図2:炎症・線維化などの疾患表現型を再現可能とする、多細胞系を一括誘導したヒト肝臓オルガノイド
(a)多様な細胞腫を含むヒト肝臓オルガノイドと、炎症・繊維化病態を再現したヒト脂肪性肝炎オルガノイド の形成過程模式図。
(b)ヒト脂肪性肝炎オルガノイドの蛍光画像とマッソントリクローム染色画像:ヒト脂肪性肝炎オルガノイド における脂肪沈着と繊維化を確認できる。
(c)Atomic force microscopy (AFM)を用いたオルガノイド の硬さの計測系。投与するオレイン酸量が多いほど、 AFMで計測されるオルガノイドの硬度が有意に高くなる。
(文献4より引用・改編) -
図3:肝臓・膵臓・胆管・腸を一体再生したヒト多臓器オルガノイド
ヒトiPSCから誘導した前腸前駆細胞と中腸前駆細胞の共培養を経て、肝胆膵組織が形成されるまでの模式図。Day 8-Day 11において境界領域の形成から各組織の自発的誘導までを捉えることができ、最終的に肝臓(赤色)、胆管(水色)、膵臓(黄色)、腸(緑色)といった複数の組織が同時に形成される。(文献5より引用・改編)
-
図4:RFタグを導入したヒト肝臓オルガノイド
ヒトiPSC培養中に数百umサイズのRFタグを導入することで、RFタグを包み込むような形状を持つ肝臓オルガノイドが形成される。オルガノイドはRFタグによって遺伝子発現やたんぱく質の機能が変化することはなく、RFタグ自体も機能や構造を損なうことなく情報の読み書き可能な状態が保たれている。そのため、RFIDリーダーと蛍光顕微鏡を組み合わせることで、例えば流路を流れる個々のオルガノイドのID認識とフェノタイピングを同時に行うスクリーニング体系を実現することができる。(文献6より引用・改編)
胚盤胞補完法の現状と展望
東京大学医科学研究所 幹細胞治療部門
山口 智之
寄稿日(2020年5月)
- 多能性幹細胞をつかったキメラ動物の作出
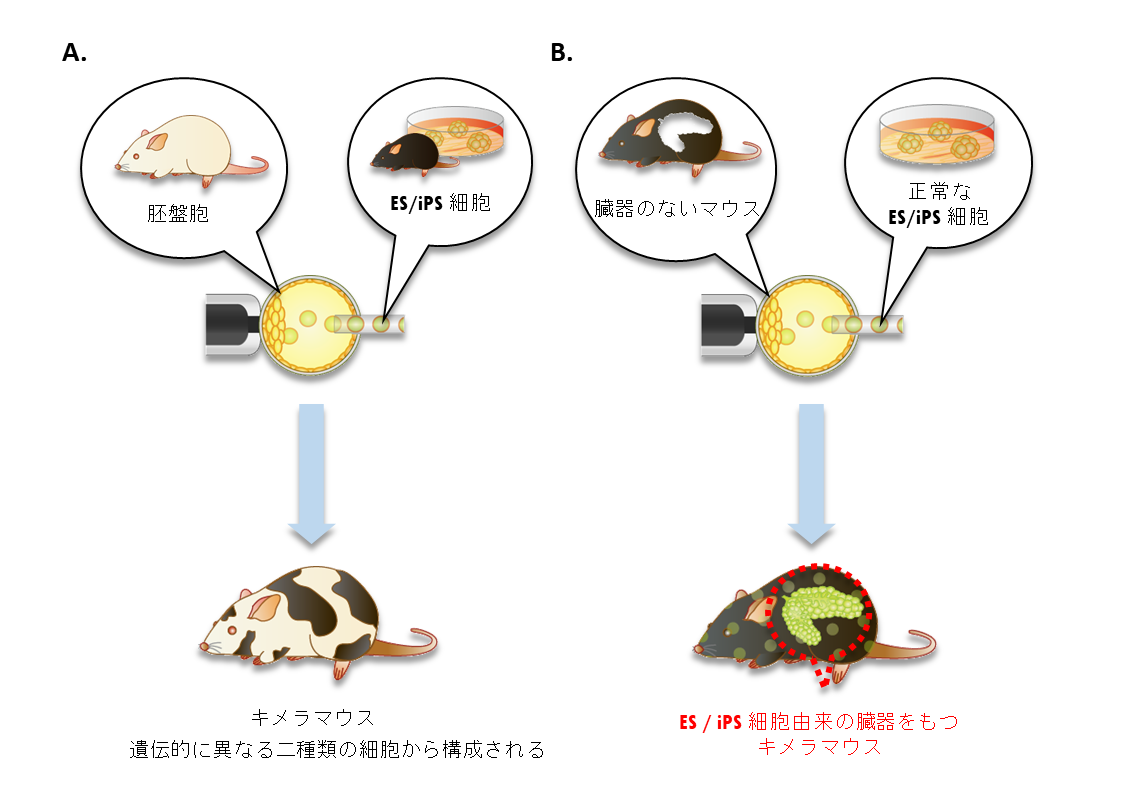
人工多能性幹細胞(iPS細胞)や胚性幹細胞(ES細胞)などの多能性幹細胞は胎盤などの胚体外組織以外のすべての組織に分化することが可能である。なかでもげっ歯類の多能性幹細胞はげっ歯類の着床前胚に注入すると、ホスト動物の発生と協調し、ホスト動物とともに体を形作ることができる。この動物がキメラであり、この能力をキメラ形成能という。
キメラはギリシャ神話に登場するライオンの頭と羊の胴体、毒蛇の尻尾をもつ怪物であるキマエラが語源であり、2種類以上の異なる遺伝型をもつ細胞によって構成される個体のことを示す。実験的には着床前胚同士の凝集または、上記のように多能性幹細胞の着床前胚への注入、そしてその胚を偽妊娠マウスの子宮に移植することによって作製する(図1A)。
キメラマウス作製技術の開発により、遺伝子改変動物の作製が可能となり、多くの生物学的疑問が解明されてきた。
この多能性幹細胞のキメラ形成能を利用し、動物体内に臓器や組織を作製する手法を「胚盤胞補完法」という。- 胚盤胞補完法とは?
胚盤胞補完法の概念は1993年にChenらが示した。彼らは免疫グロブリンの構成に必要な酵素Rag2を欠損し、成熟したリンパ球を持たないRag2ノックアウト(KO)マウスの胚盤胞に正常なES細胞を注入し、偽妊娠マウスの子宮に移植することで産まれたキメラマウス体内に、完全にES細胞由来のリンパ球を作製した(1)。つまり、遺伝的に欠損している組織を正常なES細胞が正常な発生過程を経て補完したのである。したがって論理的には臓器を欠損する遺伝子改変マウスの胚盤胞に正常マウス多能性幹細胞を注入すれば、作出されたキメラマウス体内に、完全にマウス多能性幹細胞由来の臓器を作製することが可能である。
このように臓器、組織欠損動物由来の胚盤胞に正常多能性幹細胞を注入し、キメラ動物体内に多能性幹細胞由来の臓器、組織を作製する手法を胚盤胞補完法という(図1B)。実際にこの技術によってマウス多能性幹細胞から、Pdx1KOマウスに膵臓、Sall1KOマウスに腎臓、Flk1KOマウスに血管内皮、血液、Fgfr2KOマウスに肺、Emx1-Cre, R26-DTAマウスに脳が作製され報告された(2)(3)(4)(5)(6)。さらに、げっ歯類とは発生システムの全く異なるブタにおいてもPdx1KO、Flk1KO、Sall1KO、HHEXKOブタにそれぞれ、アロジェニックなブタ胚割球(blastomere)由来の膵臓、血管内皮、血液、腎臓、肝臓の作製に成功したと報告された(7)(8)。- 異種間キメラと胚盤胞補完法
胚盤胞補完法による臓器作製の最終的なゴールは動物体内にヒトiPS細胞由来の臓器を作製し、臓器不全症に対する移植治療に用いることである。これを実現させる為にはヒトと動物間の異種キメラを作出することが必須である。
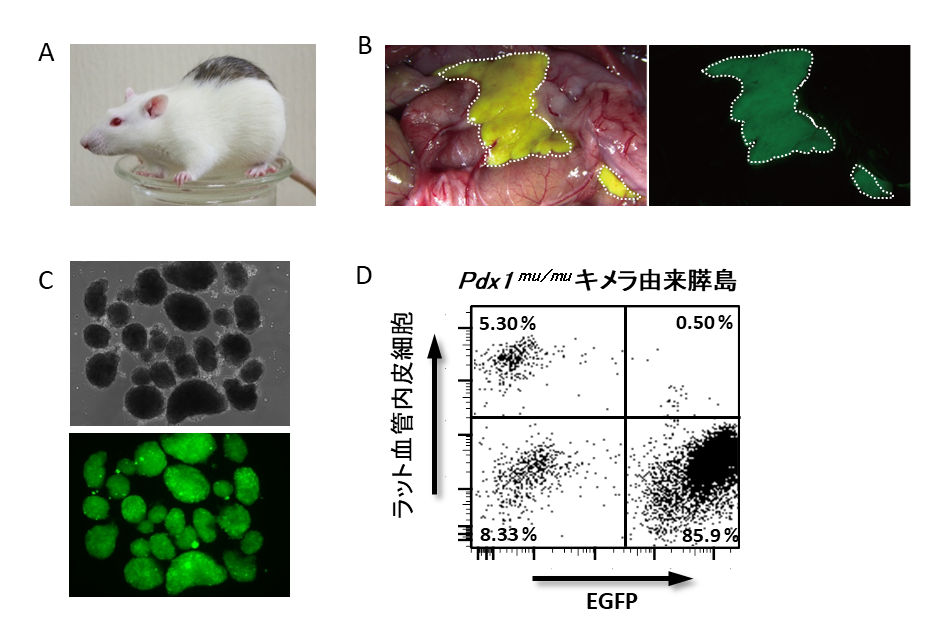
実験動物であるラットとマウスを用いた異種間キメラは2007年にKobayashiらがラットの胚盤胞にマウスの多能性幹細胞を注入したマウス→ラット異種間キメラ、マウスの胚盤胞にラットの多能性幹細胞を注入したラット→マウス異種間キメラの作出に成功している(2)。2017年には、この技術を基に、膵臓を欠損するPdx1mu/muラット胚盤胞に正常マウス多能性幹細胞を注入し、Pdx1mu/muキメララット体内にマウス多能性幹細胞由来の膵臓を作出することに成功した(9)(図2A and B)。ラット体内に作出されたマウス膵臓の免疫組織染色および画像解析の結果、内分泌組織、外分泌組織および導管組織は完全に注入したマウス多能性幹細胞由来であることが分かった。一方で、膵臓とは発生系譜の異なる血管などの支持細胞はマウスとラットの細胞が共存するキメラ状態であることも明らかとなった(9)(図2 C and D)。- 異種動物体内で作出された組織を利用した移植治療
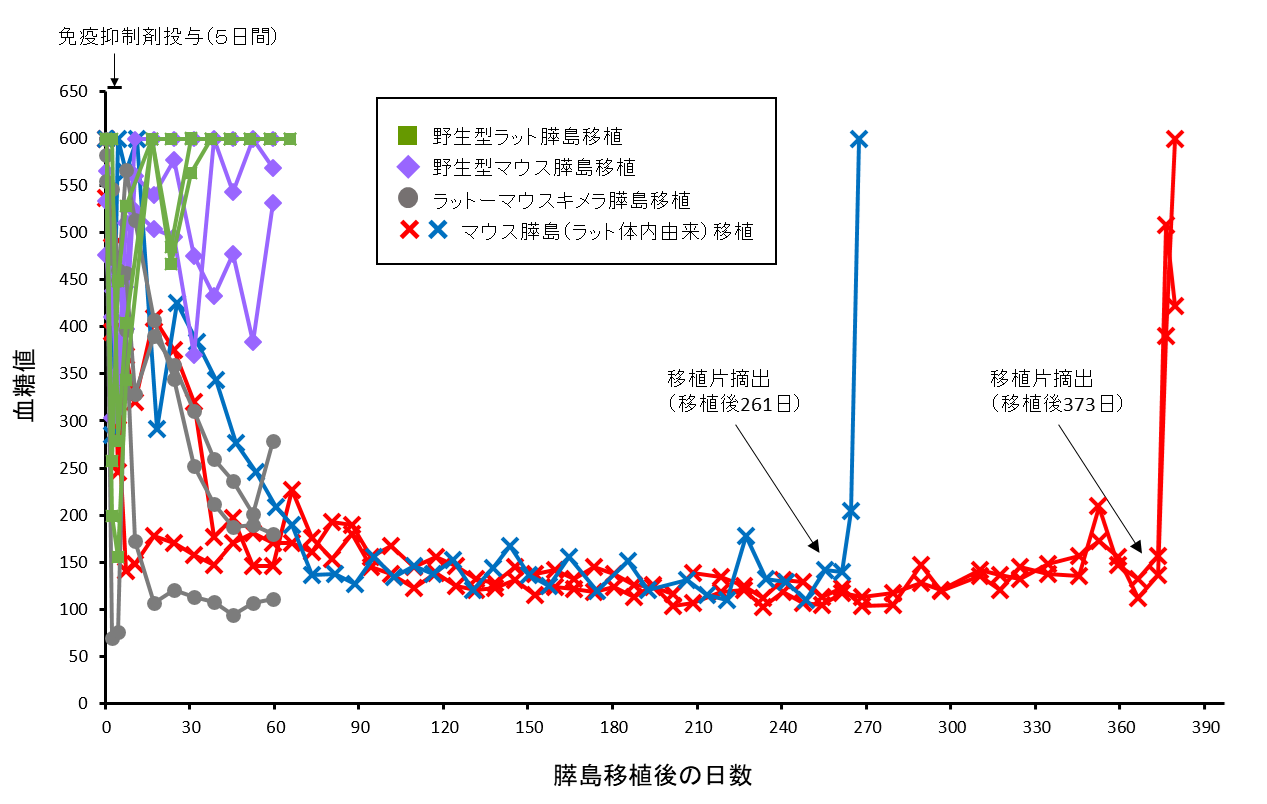
異種体内で作出された臓器に含まれる異種動物由来の支持細胞が移植治療にどのような影響を与えるのかは、今後のヒトへの応用にとって重要な問題である。 ラット体内に作製されたマウス多能性幹細胞由来膵臓より膵島を単離し、糖尿病モデルマウスに移植すると、Pdx1mu/muキメララット由来膵島を移植した糖尿病マウスは、1年以上の長期に渡って免疫抑制剤無しで正常に血糖値をコントロールすることができた。膵島移植部位を免疫染色により詳細に解析すると、移植部位摘出時まで正常な構造を保ち、インスリンを発現していた。つまり異種体内で作製された微量の異種細胞を含む膵島は継続的な免疫抑制無しで移植後1年以上その機能と構造を維持し、異種細胞は移植片の生着や機能に影響を及ぼさないことが明らかとなった(9)(図3)。これにより、胚盤胞補完法を利用した異種動物体内での臓器作製および、臓器移植治療の概念が実証された。
- ヒトへの応用に向けて
2019年7月の動物性集合胚の取り扱いに関わる関係指針の改正により、ヒトiPS細胞を注入した動物胚を動物の子宮に移植し、ヒト-動物キメラを作出する実験の施行が可能となった。いよいよヒトの臓器を動物体内に作製する実験を行う段階になったが、ヒト-動物キメラ作出には大きな壁があることも事実である。その壁の一つがげっ歯類の多能性幹細胞とヒトの多能性幹細胞の性質の違いである。げっ歯類の多能性幹細胞が着床前胚の性質に類似するのに対して、ヒトの多能性幹細胞は着床後胚の性質に類似しているのである。この性質の違いにより、ヒトの多能性幹細胞はキメラを形成することができないと考えられている。しかし、Masakiらは、アポトーシス抑制分子であるBcl2を着床後胚相当であるマウスEpiblast stem cell(EpiSCs)に過剰発現させるとキメラを形成できることを見出した(10)。さらに最近、同様の手法でヒト-マウス異種間キメラの作出も報告された(11)。まだまだヒト細胞のキメラ動物への寄与は非常に低いが、今後このシステムに更なる技術革新が加わることで、動物体内でのヒト臓器作出を実現することが期待される。
- 文献
-
- J. Chen, R. Lansford, V. Stewart, F. Young, F. W. Alt, RAG-2-deficient blastocyst complementation: an assay of gene function in lymphocyte development. Proc. Natl. Acad. Sci. U. S. A. 90, 4528–32 (1993).
- T. Kobayashi et al., Generation of rat pancreas in mouse by interspecific blastocyst injection of pluripotent stem cells. Cell. 142, 787–99 (2010).
- J. Usui et al., Generation of Kidney from Pluripotent Stem Cells via Blastocyst Complementation. Am. J. Pathol. 180 (2012), pp. 2417–2426.
- S. Hamanaka et al., Generation of Vascular Endothelial Cells and Hematopoietic Cells by Blastocyst Complementation. Stem Cell Reports. 11, 988–997 (2018).
- M. Mori et al., Generation of functional lungs via conditional blastocyst complementation using pluripotent stem cells. Nat. Med. 25 (2019), pp. 1691–1698.
- A. N. Chang et al., Neural blastocyst complementation enables mouse forebrain organogenesis. Nature. 563 (2018), pp. 126–130.
- H. Matsunari et al., Blastocyst complementation generates exogenic pancreas in vivo in apancreatic cloned pigs. Proc. Natl. Acad. Sci. U. S. A. 110 (2013), doi:10.1073/pnas.1222902110.
- H. Matsunari et al., Compensation of Disabled Organogeneses in Genetically Modified Pig Fetuses by Blastocyst Complementation. Stem Cell Reports. 14, 21–33 (2020).
- T. Yamaguchi et al., Interspecies organogenesis generates autologous functional islets. Nature. 542 (2017), doi:10.1038/nature21070.
- H. Masaki et al., Inhibition of Apoptosis Overcomes Stage-Related Compatibility Barriers to Chimera Formation in Mouse Embryos. Cell Stem Cell. 19 (2016), doi:10.1016/j.stem.2016.10.013.
- X. Wang et al., Human embryonic stem cells contribute to embryonic and extraembryonic lineages in mouse embryos upon inhibition of apoptosis. Cell Res. 28 (2018), pp. 126–129.
-
図1:胚盤胞補完法による膵臓の作製
A. コンベンショナルなキメラマウス作製法
B. 胚盤胞補完法による動物体内での膵臓作製 -
図2:異種間胚盤胞補完法でラット体内に作製したマウス膵臓
A.マウス多能性幹細胞由来膵臓をもつキメララット。
B.キメララット体内に作製されたマウス多能性幹細胞由来膵臓(点線内)。右:明視野 左:緑色蛍光
C.Pdx1mu/muキメララット体内に作製されたマウスES細胞由来膵臓より分離した膵島。上:明視野 下:蛍光
D. 単一に分離した膵島のフローサイトメトリーによる解析。マウスES細胞由来膵島にはラット血管内皮細胞が5.3%含まれていた。
文献10より引用改変 -
図3:Pdx1mu/muキメララットより分離したマウスES細胞由来膵島を移植した糖尿病モデルマウスの血糖値推移
文献10より引用改変
消化器外科領域の再生医療
長崎大学大学院移植・消化器外科/消化器再生医療学講座
丸屋 安広、小林 慎一朗、金高 賢悟、江口 晋
寄稿日(2020年5月)
- 細胞シート工学について
Okanoらにより開発された細胞シート工学は培養皿表面に温度応答性高分子であるポリ-N-イソプロピルアクリルアミド(PIPAAm)を固定化することで、温度変化のみで細胞の着脱を制御する技術です(1)。PIPAAmは32℃の相転移温度を境に水和・脱水和変化を起こす高分子であり、37℃では疎水性に変化して細胞が接着し、32℃以下では親水性に変化して細胞が着脱します(2-4)。蛋白分解酵素を用いずに細胞を回収できますので、細胞外マトリックスおよび接着因子・細胞間接着の機能を保ったまま、2次元のシート状に回収することができます。細胞シート移植は細胞懸濁液注入による細胞移植に比べて、細胞生着率が高く、体性幹細胞の補充やパラクライン効果による創傷治癒促進作用など、既存の医薬品による治療機序とは異なる新規治療開発として大きく注目されています。角膜上皮幹細胞疲弊症、重症心不全、変形性膝関節症、食道ESD後の狭窄予防、歯周組織再生、中耳粘膜再生など、様々な種類の細胞シート移植による再生医療が基礎研究から臨床応用へと進んでおります。 長崎大学大学院移植・消化器外科では細胞シート工学を用いた消化器外科領域の再生医療の研究を行っており、その研究内容の一部を紹介いたします。
- 培養上皮細胞シートを用いた食道粘膜上皮再生
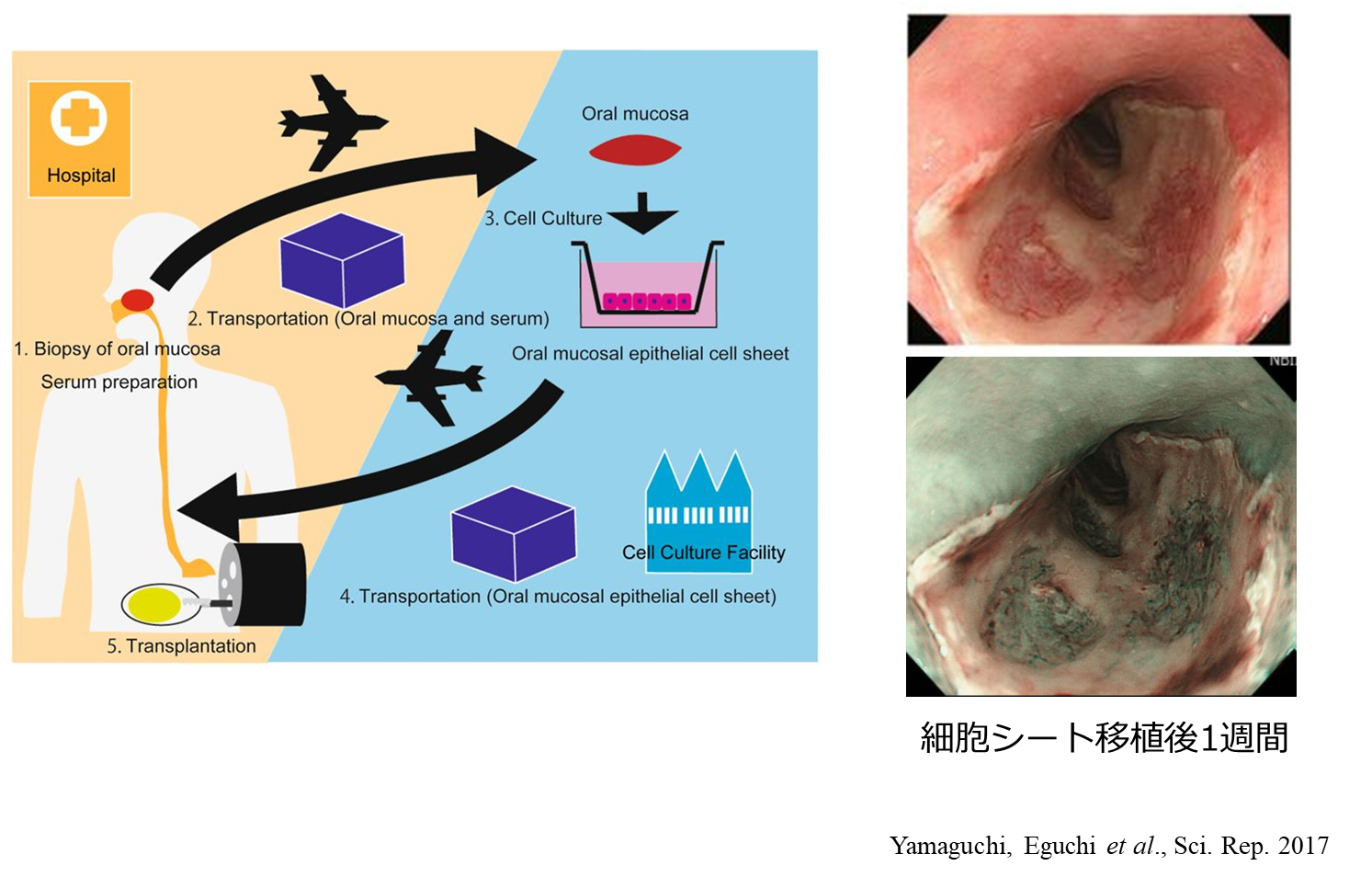
東京女子医科大学のOhkiらは培養上皮細胞シートを用いた食道内視鏡的粘膜下層剥離術(ESD)後狭窄予防の臨床研究を実施し、安全性と有効性を示しました (5)。細胞シートのような再生医療等製品の製造には、医薬品レベルの製造可能な細胞加工施設(CPC)と製造技術が必要ですが、CPCの使用および管理には多額のコストがかかることからCPCを完備できる病院は限られています。本技術を一般の病院でも普及させるためには、輸送システムの確立と多施設での細胞組織移植治療の再現性が必要です。そこで長距離輸送による安全性評価を行う目的で我々は東京女子医科大学先端生命医科学研究所と共同で、細胞調整施設間で培養上皮細胞シートを輸送させる研究を行いました。陸路ではなく空路での輸送を行い、気圧や温度が及ぼす影響を検討し、細胞の品質低下がなく、無菌性が担保されること確認しました(6)。その上で長崎大学病院においてESDを行う早期食道癌患者の血液と口腔粘膜の一部を採取して、東京女子医科大学CPCへ輸送し、同CPCで作製した細胞シートを長崎大学病院へ再度輸送して、ESD後の食道粘膜切除面に移植するという臨床研究を行いました。10例の患者さんに臨床研究を行い、全例で採取、製造、移植まで安全に行えたことを確認しました。5/6~全周性のESDを施行したにも関わらず、6例で狭窄を認めず、狭窄を認めた4例でも数回のバルーン拡張のみで狭窄は改善し良好な成績を得ました(7)(図1)。
- 脂肪由来幹細胞シートを用いた消化管再生
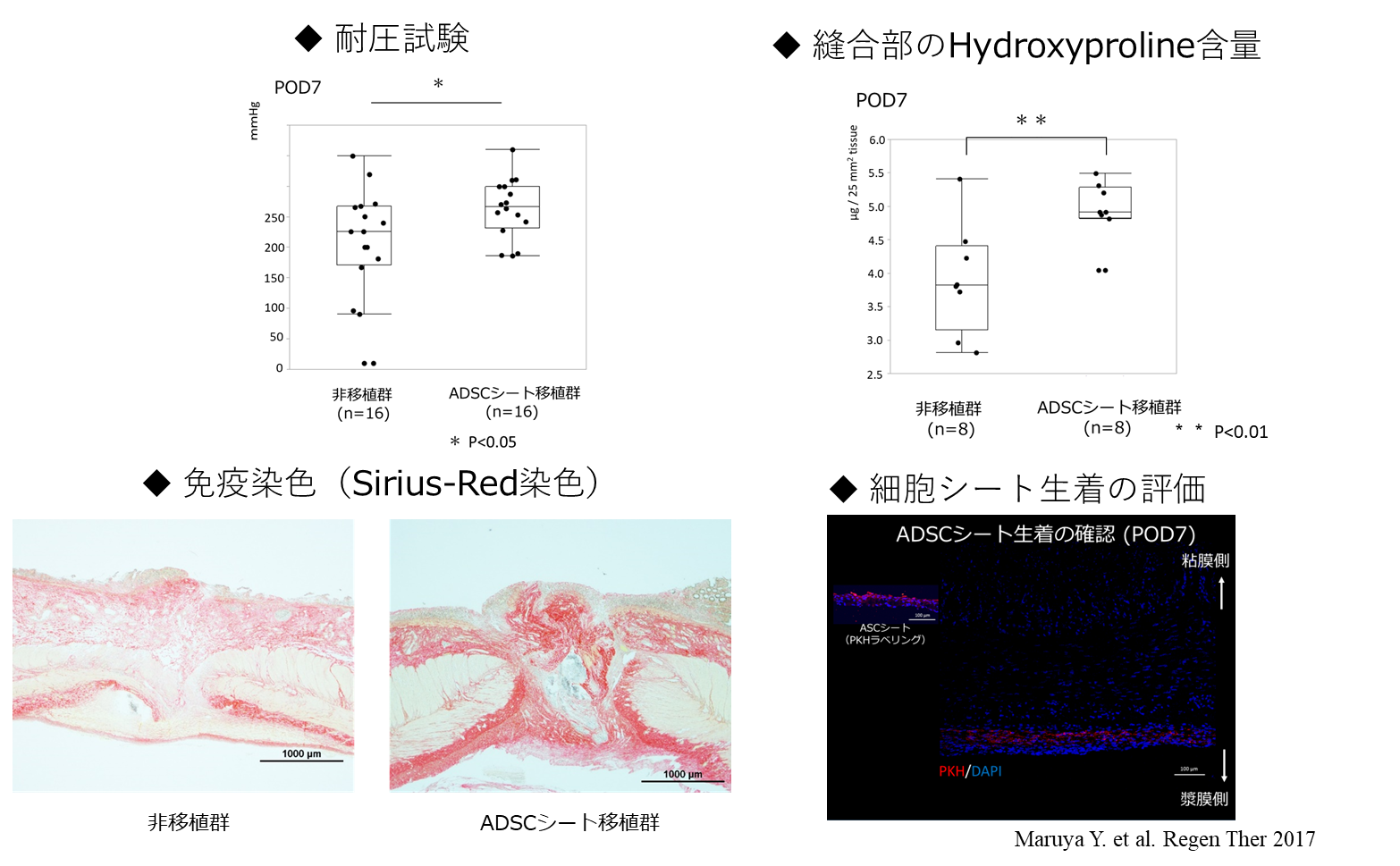
放射線治療や炎症性腸疾患などに伴う消化管穿孔は創傷治癒遅延のため、治療に難渋することがあります。脂肪由来幹細胞(ADSC)は組織の再生と修復に関わる多分化能を持った細胞で種々の創傷治癒因子を含むサイトカインを産生することが知られています。そこで我々は、ミニブタを用いて消化管縫合部創傷治癒遅延モデルを作成し、消化管縫合部に対して自己ADSCシート移植の効果を検証しました。ADSCシート移植は術後1週間後の縫合部のコラーゲン増生を促進し、縫合部の物理的強度が増強することが分かりました。消化管縫合部への自己ADSCシート移植は消化管縫合不全を予防・軽減できる可能性が示されました(8)(図2)。 また、縫合不全以外にも便失禁などに対してADSCシートが有効であるか検証を行いました。近年、肛門に近い下部直腸癌に対して肛門を温存しつつ肛門括約筋を切除する術式(内肛門括約筋切除術:ISR)が可能となりましたが、ISR術後の便失禁や排便調節不良などの肛門機能障害が問題になることがあります。これまで、当科ではラットの肛門機能不全モデル(9)に対して自己ADSCを局所に注入することによって機能改善を試みてきましたが、細胞を播種し目標部位で分化・増殖させることが困難であり、肛門内圧の改善に限界がありました。しかし、ADSCシートを移植することによって、細胞を局所に停留させ、更に有効な肛門機能改善を得ることができました(10)。
- 筋芽細胞シートを用いた消化管再生
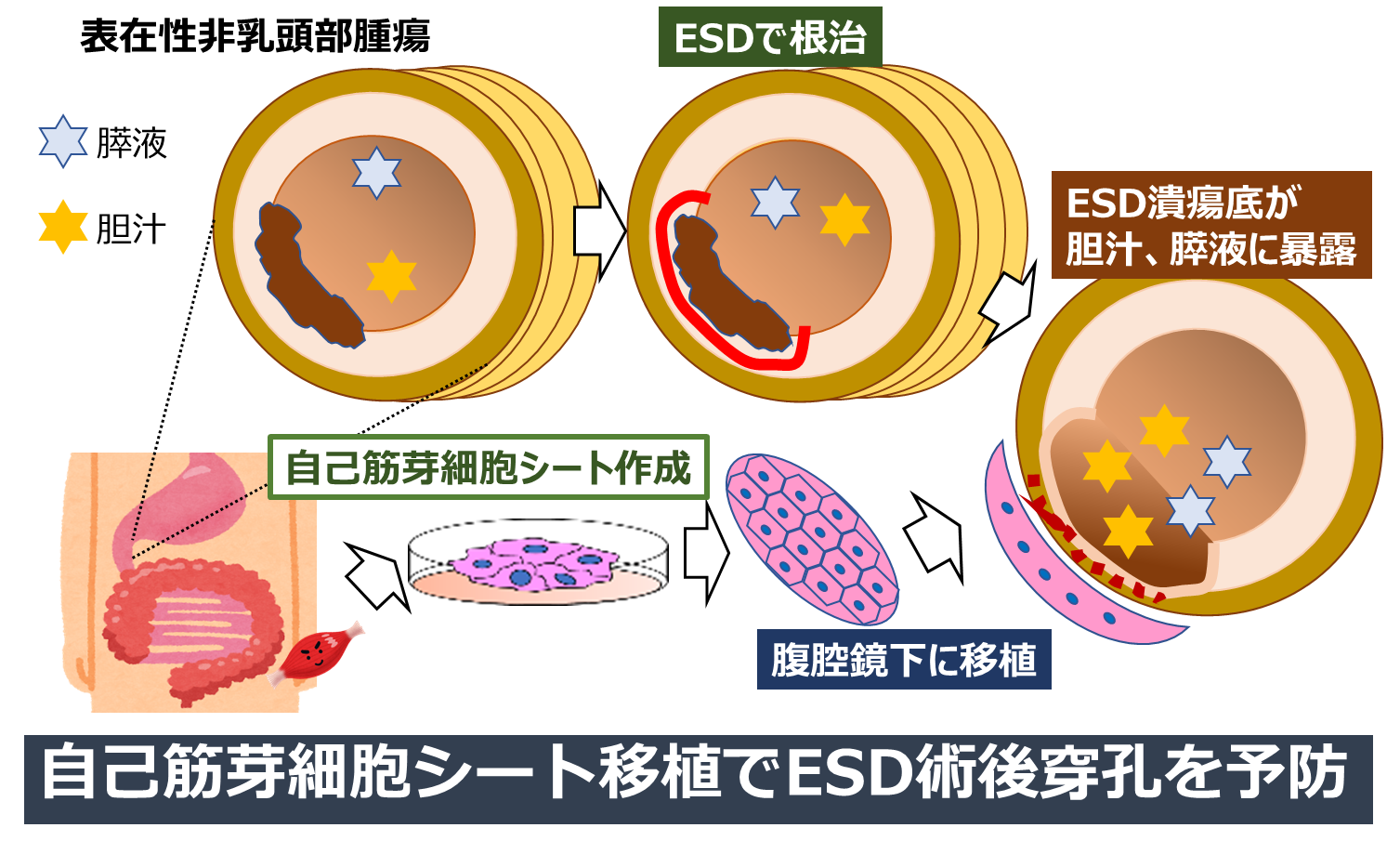
十二指腸腫瘍はまれな腫瘍であり、特に表在型非乳頭部十二指腸腫瘍(superficial non-ampullary duodenal epitherial tumor; SNADET)の頻度は全消化管腫瘍の1-2%されています(11)。この頻度の低さゆえに標準治療が確立されていないのが現状です。SNADETに対して術来は十二指腸部分切除術や膵頭十二指腸切除などが行われていましたが、最近では内視鏡治療(内視鏡粘膜切除術:EMR/内視鏡粘膜下層剥離術:ESD)や腹腔鏡内視鏡合同切除(LECS)を選択する施設が増えつつあります。EMRはスネアがかかる病変までは比較的安全に施行できますが、サイズが大きくなると分割切除を余儀なくされ、病理学的評価が難しく遺残再発のリスクがあります。ESDは十二指腸の解剖学的特性(腸管が狭く屈曲しているうえに、消化管壁が非常に薄く、更に胆汁や膵液に暴露される)から約10-30%と他の消化管に比べて高確率で術後穿孔を来すことが問題点として挙げられます(12)。またLECSは高度な内視鏡縫合手技を伴う点や、腹腔内腫瘍散布のリスクのために未だ標準治療となり得ていません。そのため、腫瘍径が大きなSNADETに対する安全性・根治性・低侵襲性を満たす治療法がないのが現状です。 我々は気管・食道・咽頭など様々な組織欠損や難治性瘻孔に対する筋皮弁移植からヒントを得て、培養筋芽細胞シートに注目しました(13, 14)。これまでに、胃穿孔や膵切除断端の膵液瘻に関して、作製した疾患モデルラットに筋芽細胞シートを移植することにより治療し得ることを実証しました(15, 16)。これらの背景から、筋芽細胞シートは十二指腸ESDの術中/遅発性穿孔の予防に有用でないかという着想に至りました。我々はこれまでに、ESD後100%遅発性穿孔を来すブタ十二指腸ESDモデル(17)を作成し、同モデルに対して自己筋芽細胞シートを十二指腸ESD後漿膜側に移植すると術後穿孔が100%予防できることを実証しました。また今後の腹腔鏡下細胞シート移植への展開を見据え、医工連携により腹腔鏡移植用デバイスの開発に成功しました。 これらの成果を基に臨床応用を目指してテルモ株式会社に共同研究講座「消化器再生医療学講座」を開設していただき、研究を進めております。更に令和2年度のAMED再生医療実用化事業に採択いただき、SNADETを対象に「ESD+腹腔鏡下自家骨格筋芽細胞シート移植」による再生細胞治療法の安全性及び有効性を探索的な医師主導治験により確認する予定です(図3)。
- 文献
-
- Okano T, Yamada N, Sakai H, et al. A novel recovery system for cultured cells using plasma-treated polystyrene dishes grafted with poly(N-isopropylacrylamide). J Biomed Mater Res. 27:1243-1251,1993
- Kobayashi J, Okano T. Fabrication of a thermoresponsive cell culture dish: a key technology for cell sheet tissue engineering. Science and Technology of Advanced Materials. 11:1-12,2010
- Okano T, Yamada N, Okuhara M, et al. Mechanism of cell detachment from temperature-modulated, hydrophilic-hydrophobic polymer surfaces. Biomaterials. 16:297-303,1995
- Yamato M, Okuhara M, Karikusa F, et al. Signal transduction and cytoskeletal reorganization are required for cell detachment from cell culture surfaces grafted with a temperature-responsive polymer. J Biomed Mater Res. 44:44-52,1999
- Ohki T, Yamato M, Ota M, et al. Prevention of esophageal stricture after endoscopic submucosal dissection using tissue-engineered cell sheets. Gastroenterology. 143:582-588 e581-582,2012
- Takagi R, Kobayashi S, Yamato M, et al. How to prevent contamination with Candida albicans during the fabrication of transplantable oral mucosal epithelial cell sheets. Regen Ther. 1:1-4,2015
- Yamaguchi N, Isomoto H, Kobayashi S, et al. Oral epithelial cell sheets engraftment for esophageal strictures after endoscopic submucosal dissection of squamous cell carcinoma and airplane transportation. Sci Rep. 7:17460,2017
- Maruya Y, Kanai N, Kobayashi S, et al. Autologous adipose-derived stem cell sheets enhance the strength of intestinal anastomosis. Regen Ther. 7:24-33,2017
- Yamaguchi I, Fujita F, Yamanouchi K, et al. A novel animal model of long-term sustainable anal sphincter dysfunction. J Surg Res. 184:813-818,2013
- Inoue Y, Fujita F, Yamaguchi I, et al. Improvement of Anal Function by Adipose-Derived Stem Cell Sheets. Dig Surg. 35:64-69,2018
- 矢作直久 十二指腸腫瘍の内視鏡診断と治療の動向 胃と腸 54(8): 1085-1087, 2019
- Fujihara S, Mori H, Kobara H, et al. Management of a large mucosal defect after duodenal endoscopic resection. World J Gastroenterol. 22: 6595-6609, 2016.
- Miyagawa S, Saito A, Sakaguchi T, et al. Impaired myocardium regeneration with skeletal cell sheets--a preclinical trial for tissue-engineered regeneration therapy. Transplantation. 90:364-372,2010
- Yoshikawa Y, Miyagawa S, Toda K, et al. Myocardial regenerative therapy using a scaffold-free skeletal-muscle-derived cell sheet in patients with dilated cardiomyopathy even under a left ventricular assist device: a safety and feasibility study. Surg Today. 48:200-210,2018
- Tanaka T, Kuroki T, Adachi T, et al. Development of a novel rat model with pancreatic fistula and the prevention of this complication using tissue-engineered myoblast sheets. J Gastroenterol. 48:1081-1089,2013
- Tanaka S, Kanetaka K, Fujii M, et al. Cell sheet technology for the regeneration of gastrointestinal tissue using a novel gastric perforation rat model. Surg Today. 47:114-121,2017
- Hashiguchi K, Maruya Y, Mastumoto R, et al. Establishment of an in-vivo porcine duodenal delayed perforation model after endoscopic submucosal dissection. Digestive Endosco. 2020 in press.
ES細胞のプロジェクトについて
国立成育医療研究センター
梅澤 明弘
寄稿日(2022年4月)
わたしどものES細胞のプロジェクトを紹介したい。大きな6つのポイントがある。
・多能性幹細胞には、iPS細胞に加え、胚性幹細胞(ES細胞)が存在し、再生医療製品の原料になる。
・ES細胞が有する多分化能と無限増殖能の性質を利用して、一定の特性と品質を持つ細胞を大量に供給するシステムを構築し、再生医療への応用が期待されている。
・我が国では、京都大学と国立成育医療研究センターにてヒトES細胞が樹立されている。
・米国では、ES細胞を原料とした再生医療製品が開発され、治験が精力的に進められている。
・ヒトES細胞を再生医療製品の原料とする場合、医薬品医療機器等法とは別に国の倫理指針に従う必要がある。
・再生医療製品は生存する細胞から形成され、臨床的局面を含めて臨床医としての貢献は大きい。- ヒトES細胞とは
ES細胞は1983年、エバンス博士によってマウスで作製され、その功績によってノーベル賞を受賞した。次いで1998年にトムソン博士(ウィスコンシン大学)によってヒトES細胞が作製された。ES細胞は胚盤胞期の胚の一部に属する内部細胞塊より作られ、各国のアカデミア及び企業で樹立されてきている。英国、米国、イスラエル、シンガポール、韓国、中国など各国が研究を行なわれている。一例をあげると、網膜色素上皮、膵内分泌細胞や神経細胞の研究開発が先行する。ES細胞の細胞医療への応用においては、ES細胞が有する多分化能と無限増殖能の性質を利用して、一定の特性と品質を持つ細胞を大量に供給するシステムを構築し、細胞医療への応用が期待される。我が国では、京都大学と国立成育医療研究センターがES細胞を作製し、このふたつの組織がES細胞を使ってみたいという申し出があれば、京都大学ないしは国立成育医療研究センターが国の指針を守るために必要なことや手続きをサポートする。日本では100の機関がES細胞の研究を実施してきている。ES細胞は、iPS細胞といわば兄弟でよく似た性質があり、不死の細胞で無限に増える力があり、また、どんな細胞にもなれるという多分化能を有する。昨今、ES細胞やiPS細胞を使った再生医療には大きな注目が集まっており、研究の発展に大きな期待を寄せられる。特に、小児の領域では、臓器及び組織が形成されず、欠損している場合があり、ES細胞を用いた再生医療製品が有効な局面が多くあると想定する。
再生医療のためのES細胞バンクを構築する際には、ES細胞を原料にするだけではなく、肝臓細胞に分化させた状態でストックするということも可能である。必要に応じて必要な細胞を増やして包装し、患者さんに届けることを考えている。医療においては有効性とともに安全性が重要であり、日本の制度の枠組みの中で、医師、研究者、産業界、行政そして患者さんが一丸となって病気と闘っていくことが肝要である。例えば、インスリンを産生するβ細胞を薬剤として投与することは、血糖値に応じたインスリンが産生され、理論的に理想的な治療法となる。その他の治療では、ドーパミン産生神経細胞によるパーキンソン病、神経細胞による脊髄損傷、心筋細胞による心筋梗塞・心筋症、肝細胞による肝機能障害、骨芽細胞による骨粗しょう症、筋芽細胞による筋ジストロフィー、造血幹細胞による白血病、表皮細胞による火傷といった治療法が想定されている。割り切れば、世界においてはこれらの再生医療をES細胞を原料として実現しようとしており、我が国ではiPS細胞を原料として実現しようとしている(1)。- 国立成育医療研究センターの取り組み
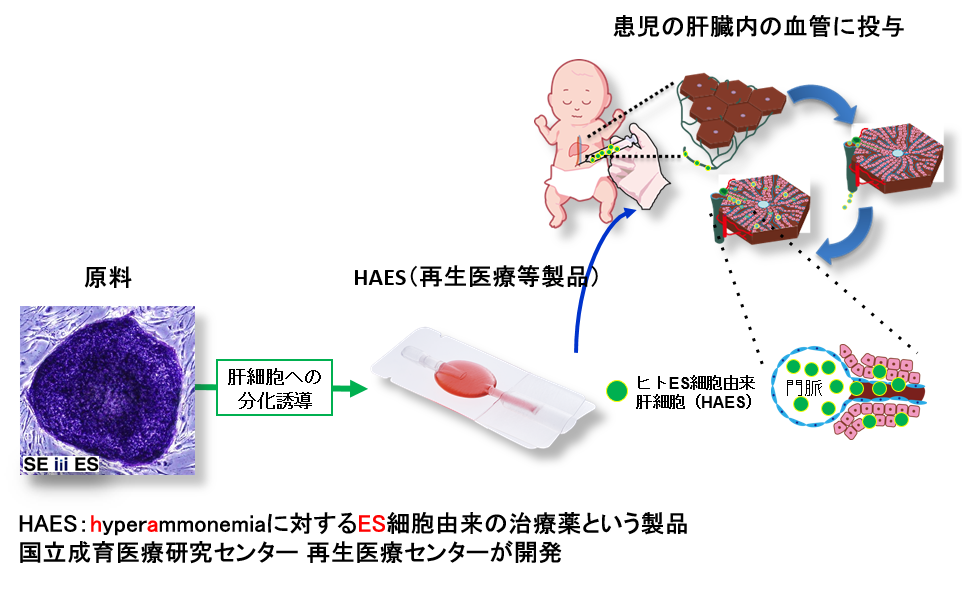
私たちも、アンモニアの代謝ができない遺伝病のお子さんの治療のため、ES細胞を使った治験薬の製造を進めている。アンモニアは通常は肝臓で分解され、無害な物質になる。ところが、アンモニアの分解ができず体にどんどんたまってしまう病気があり、アンモニアがたまると他の組織や臓器、特に脳に障害が出るので、生まれてすぐに治療する必要がある。しかし、現状では肝臓移植しか治す方法がないことより、ES細胞からアンモニアを代謝できる肝細胞を作製し、病気の新生児の体内に入れる治療を計画した。これは、肝移植の余剰肝細胞移植の成功に基づいて計画され、細胞はへその緒から肝臓までカテーテルを挿入し、投与する。尿素サイクル異常症に対する肝細胞移植は全世界で報告(2)があり、多くは新生児発症型OTC欠損症である。肝細胞移植後も高アンモニア血症をきたす場合があり、集学的な治療が必要であるが、肝細胞移植後は管理が容易になったという感触が得られている。生体肝や脳死肝から調製される肝細胞は、品質を一定に保つことが困難であり、一つのロットの細胞数にも限りがある。そのため、ヒトES細胞から分化させたアンモニア代謝能を有する細胞への分化が方向づけられた肝細胞を製造することに決めた。それは、米国におけるヒトES細胞由来分化細胞を用いた臨床試験を参考にした(3)。幸運なこととに、ヒトES細胞を原料とする再生医療等製品にかかるヒトES細胞加工医薬品等の品質及び安全性に考え方が示されていたので、それに従い、開発を行った(4)。前臨床研究として、免疫不全OTC欠損Scidマウスを用いた。肝移植がすぐに実施できない新生児期発症型の患児に対し、アンモニア代謝の改善及びアンモニア発作の抑制が期待され、国立成育医療研究センターの研究所と病院がそれぞれ別々に準備を進めていった(図1)。
医師主導治験で、現在までにすでに目標症例5例の対象患者に治験プロトコール上の実施項目を完了している(図2)。治験のエントリーを終えた被験者に対しては長期フォローアップを開始している。予め凍結保存したヒトES細胞由来の再生医療等製品(肝細胞)を解凍し、臍帯静脈または門脈より細胞を投与した(図3)。肝細胞はヒトES細胞を原材料としたヒト胚性幹細胞加工製品であり、ヒトES細胞を原材料とした製剤の長期の安全性は確立していない。ヒトES細胞を原材料とした製剤では、未分化のES細胞が製剤中にわずかに混入する可能性を完全に否定することは難しく、混入したES細胞が、製剤を移植した体内で腫瘍を形成する可能性を完全に否定することはできない。これらのことを踏まえて、細胞移植を受けた患者において、製剤由来の腫瘍形成が認められないこと含む安全性を、可能な限り長い観察期間で安全性を確認する必要がある。また、尿素サイクル異常症の患者は、高アンモニア血症が不可逆的な中枢障害を起こし、精神発達遅滞が生じることが知られており、肝細胞移植患者の成長過程における有効性の検証も必要である。最後に、一定品質の再生医療等製品を堅牢なシステムに基づいて製造ができるかを引き続き検証(ベリフィケーション)する必要がある。さらには、製品を継続的に提供するオペレーション /経営が必要不可欠である。
- 文献
-
- Umezawa, A, Sato Y, Kusakawa S, Amagase R, Akutsu H, Nakamura K, Kasahara M, Matsubara Y, Igarashi T. Research and Development Strategy for Future Embryonic Stem Cell-Based Therapy in Japan. JMA J, 3(4): 287-294, 2020.
- Enosawa S, et al. Hepatocyte transplantation using a living donor reduced graft in a baby with ornithine transcarbamylase deficiency: a novel source of hepatocytes. Liver Transpl. 20(3): 391-3. 2014.
- Schwartz SD, et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. Lancet. 385: 509-516. 2014.
- 早川堯夫, 梅澤明弘, 山中伸弥, 小澤敬也, 大和雅之, 澤芳樹, 山口照英, 松山晃文, 佐藤陽治, 中内啓光. ヒトES細胞加工医薬品等の品質及び安全性の確保に関する指針案(中間報告). 再生医療. 9(1):166-180. 2010.
-
図1:ヒトES細胞由来肝細胞を用いた先天代謝異常症の治験を行う国立成育医療研究センター。
左の建物が製造を行う研究所であり、右の建物が臨床試験を行う病院施設である。研究所が治験薬製造に責任を持ち、医師チームが製造を含めた医師主導試験全体の責任を担う。
-
図2:ヒトES細胞由来肝細胞を用いた先天代謝異常症に対する医師主導試験の概要
-
図3:再生医療等製品(治験薬)の投与を行う医師チーム
ファースト・イン・ヒューマン試験では、「新生児」に対して、「血管内」に投与し、「ヒトES細胞」由来の治験薬を投与することより、医師チームには慎重な対応が求められた。ファースト・イン・ヒューマン試験の専門家をまねき、その考え方をしっかり学ぶ必要があった。
消化管吸収の謎を解明する実験外科技術―最近のトピックより
東京慈恵会医科大学 産学連携講座 腎臓再生医学講座
小林 英司
寄稿日(2022年6月)
消化器病を専門とする皆さんに、「腸管上皮を剥ぐ」などの技術で消化管吸収のなぞ解きに挑み、またその原理を治療に応用した著者らの最近の共同研究を紹介します。
- 大腸上皮を剥いで小腸化する 1)
小腸を大量に失った患者や腸管運動機能不全の患者は、高カロリー輸液を始めとする腸管リハビリテーションの進歩によりその予後に格段の改善がみられてきました。しかし、重症例は経静脈栄養に依存し、カテーテル関連血流感染症や腸管不全関連肝障害などの合併症リスクを伴います。また外科的治療法として、残存する小腸の拡張する場合はSTEP等の腸管延長術が試みられています。一方、根本的な治療法として小腸移植が登場しましたが、他の移植臓器に比し高いグラフト拒絶率・死亡率により、移植治療後の管理に難渋しています。
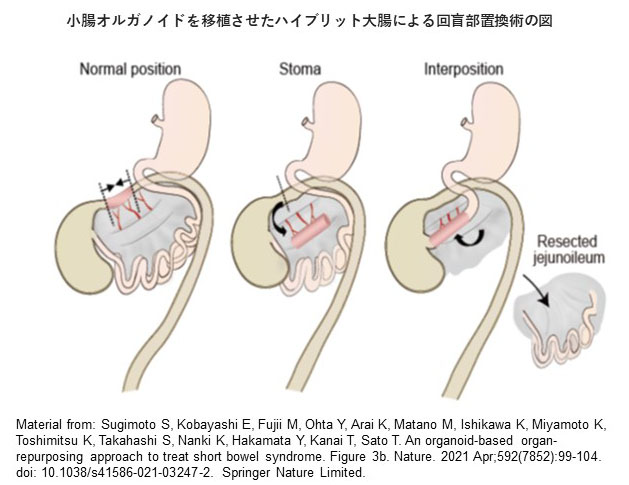
慶應義塾大学医学部坂口光洋記念講座(オルガノイド医学)佐藤俊朗教授らと5年来の計画でこの計画を進めてきました。佐藤教授らが開発した腸管オルガノイド技術を用いて、残存する部分大腸の一部を分節グラフトとし、その上皮のみ自己小腸オルガノイドを移植して有茎ハイブリッドグラフトの作成することを考えていました。そして、このハイブリット腸管を本来の回盲部にインターポジションする新しい外科的技術を編み出しました(図1)。
この外科的手技で、ハイブリット大腸は、栄養吸収に関わるリンパ管と大腸本来の蠕動という機能の両方を手に入れることになりました。この腸管の蠕動運動は、胎仔期に形成された腸管内の非吸収成分を送り出す機能で、生後に神経前駆細胞を単独で追加しても本来のものを送るという組織、臓器としての動きはできないと考えられています。
この栄養吸収に関わるメカニズムを見るために、大腸と小腸のオルガノイドをシート状に培養し、細胞が平面的に広がった状態で培養液を人工的に攪拌して「流れ」を作り、この環境下でさらに培養しました。すると、小腸オルガノイドは管腔側に突出する絨毛様の構造を形成したが、大腸オルガノイドではそのような変化はみられず平面のままであり、「流れ」に依存する小腸上皮に特有の絨毛形成メカニズムが存在することが判明しました。この斬新なメカニズムを解明したのは、一緒に実験を進めてくれた同講座の杉本真也先生でした。- 大腸粘膜を剥いて大腸から酸素を入れる 2)
新型コロナウイルス感染症が猛威を振るってすでに3年を経過しています。関連の重症呼吸器合併症においても認められる低酸素血症を伴う呼吸不全に対し、生命維持を目的として人工呼吸器や人工肺による集中治療が行われています。しかし、肺以外の臓器を使って新たな呼吸管理法ができないものでしょうか。
この研究は、東京医科歯科大学統合研究機構の武部貴則教授のグループとの共同研究ですが、水棲生物の中には、ドジョウの様に低酸素環境下で生存するために腸から呼吸をするという独特な仕組みを哺乳類に応用できないかと考えたことから発しています。京都大学呼吸器外科出身の岡部亮先生が、マウスの大腸の粘膜を剥いで、大腸から酸素を入れるという基礎実験をやってこられたことから始まっています。そしてマウスに対して腸管内に純酸素ガスもしくは酸素が豊富に溶けたパーフルオロカーボン注入する方法を開発しました。私はブタ実験が得意ですので、超高齢なブタモデルを用いてこの腸呼吸の方法の有効性検証を実施しました(図2)。- 腸管吸収は気体?液体? 3)
水素を多く含む水を飲むことは、水素を摂取する一般的な方法と考えられています。疲労回復や認知機能改善などに水素を多く含む水を飲むことが有効であることは多くのヒトでの研究で示唆されています。しかし、水素水を飲用した時、実際に水素が体内に入り、どのように分布するかは知られておらず、水素水の効果に関する信憑性には疑問が残されていました。水素水を飲用した時の水素の体内への吸収・分布・代謝・排泄についてヒトで検証することは極めて困難であるところから、ブタモデルで検証することにしました。
この研究は、慶應義塾大学医学部内科学教室(循環器)の市原元気助教、佐野元昭准教授と同大学グローバルリサーチインスティテュート水素ガス治療開発センターの活動のなかで行いました。
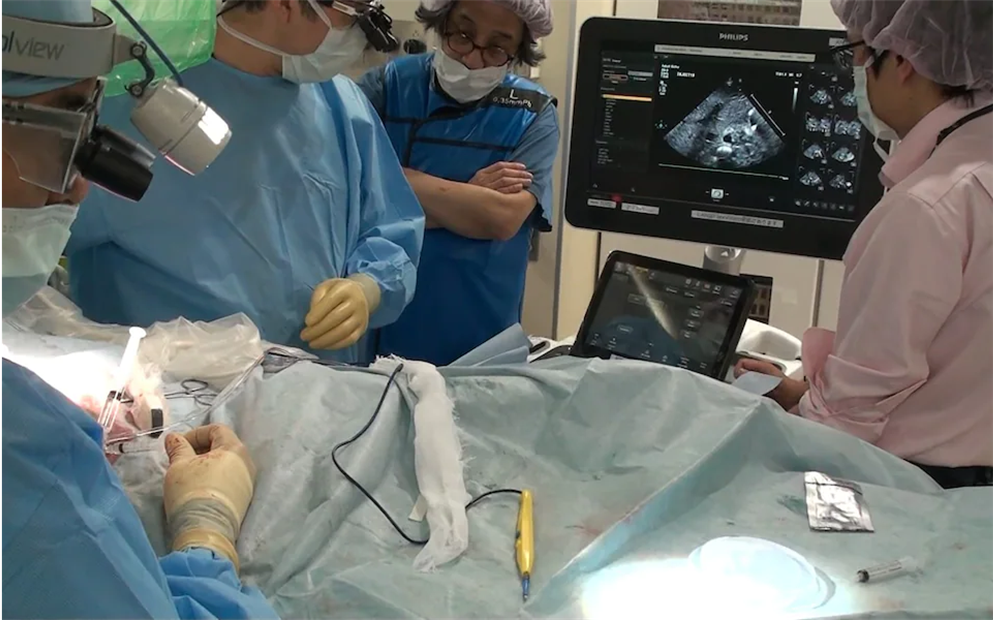
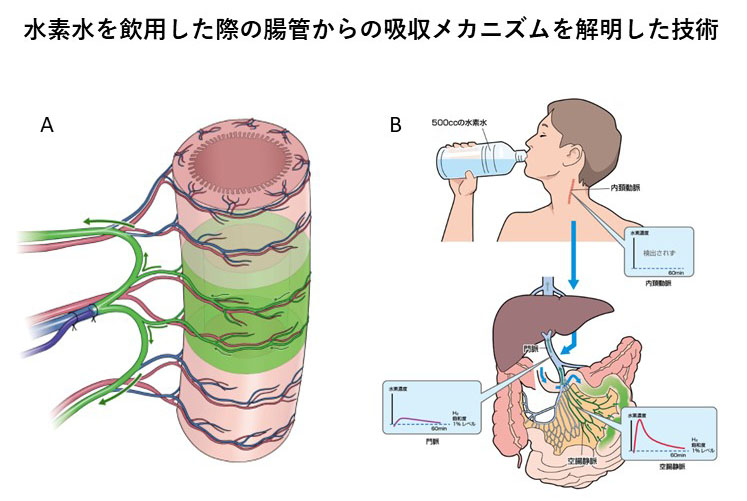
実験は、8週齢の雌ブタ4頭の空腸静脈、門脈、肝下大静脈、頸動脈に採血用のカテーテルを挿入しました。採血用にカテーテルチューブを入れることは、実験では一般的ですが、本研究では、水素水が飲用された時の空腸領域に腸管のうっ血を起こさないでカテーテルを留置する新しい技術を開発しました(図3A)。
実験は、水素含有(水素飽和度340%)または水素なしのグルコース溶液500mlを、胃前庭部から空腸に挿入したチューブを介して2分以内に空腸に注入し、120分間にわたって、静脈血および動脈血中の水素濃度の変化を測定しました。水素含有グルコース溶液の注入後、水素水の注入領域に当たる空腸静脈から再現性をもって極めて高い水素が検出されました。その後、肝臓につづく門脈中の水素濃度は、他の腸管領域(回腸や大腸)からの血液の合流で希釈されピーク時で0.05mg/L程度でしたが、1時間後まで0.016mg/L(水素飽和度1%)以上を保持しました。一方、水素なしのグルコース溶液では、注入後に水素濃度は上昇しましたが0.001mg/L(水素飽和度0.06%)以下ときわめて低値で推移しました。頸動脈では水素が検出されなかったことから、飲料水として水素を服用した場合、水素は腸管から吸収され、肝臓で代謝されたか、肺を経由している間に呼気中に排出され、動脈血を介して全身に供給されることはないと考えられました(図3B)。
- 文献
-
- Sugimoto S, Kobayashi E, Fujii M, Ohta Y, Arai K, Matano M, Ishikawa K, Miyamoto K, Toshimitsu K, Takahashi S, Nanki K, Hakamata Y, Kanai T, Sato T.: An organoid-based organ-repurposing approach to treat short bowel syndrome. Nature. 2021 Apr;592(7852):99-104. doi: 10.1038/s41586-021-03247-2. Epub 2021 Feb 24.
- Okabe R, Chen-Yoshikawa TF, Yoneyama Y, Yokoyama Y, Tanaka S, Yoshizawa A, Thompson WL, Kannan G, Kobayashi E, Date H, Takebe T.: Mammalian enteral ventilation ameliorates respiratory failure. Med (N Y). 2021 Jun 11;2(6):773-783.e5. doi: 10.1016/j.medj.2021.04.004. Epub 2021 May 14.
- Ichihara G, Katsumata Y, Moriyama H, Kitakata H, Hirai A, Momoi M, Ko S, Shinya Y, Kinouchi K, Kobayashi E, Sano M. Pharmacokinetics of hydrogen after ingesting a hydrogen-rich solution: A study in pigs. Heliyon. 2021 Nov 11;7(11):e08359. doi: 10.1016/j.heliyon.2021.e08359. eCollection 2021 Nov.
Tissue Engineeringの最前線~細胞を元気にする細胞バイオテクノロジー技術~
京都大学医生物学研究所 生体材料学分野
田畑 泰彦
寄稿日(2023年3月)
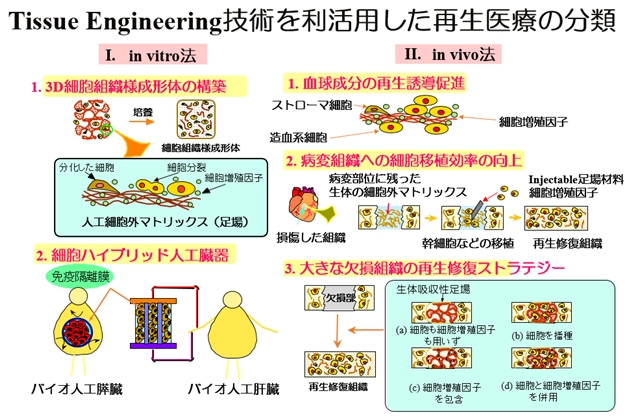
「再生医療」とはどのようなものであろうか?ここでは、「医療」を「治療」と「研究」(将来の治療を支える)に分けて考えてみる。細胞移植によって病気を治すことが一般的な再生治療のイメージであろう。これは間違いではない。その本質は、患者自身のもつ自然治癒力を高め、病気を治すことである。自然治癒力の基は細胞の増殖、分化能力である。そこで、再生治療を実現には、何らかの方法で、体内での細胞能力を高め、細胞を元気にすることが必要不可欠となる。その方法の一つは、バイオマテリアルを利活用して細胞によい周辺環境を与えて細胞を元気にすることである。この細胞の周辺環境作り与える医工学がTissue Engineering(組織工学)である(図1)。バイオマテリアル(生体材料)とは、体内で用いる(医療機器に代表される)、あるいは細胞および生体物質(タンパク質、糖、核酸など)あるいは細菌、ウイルスなどと触れて用いられるマテリアルである。
細胞の周辺環境は、細胞外マトリクス(細胞の住家)と液性シグナル因子(細胞の栄養)とからなっている。細胞が好む素材で住家を作り、細胞に栄養をドラッグデリバリーシステム(DDS)技術を使ってうまく与えることができれば、本来の体に備わっている細胞が必要な部位で元気になり、病気を治すであろう。また、細胞の住家(人工足場)や栄養の整備により移植細胞の体内生存率と機能を高める、必要部位に細胞を移動(体内動員)させる、あるいは周辺環境としての炎症反応を制御するなど、いろいろな方法によって体内で細胞を元気にすることによっても再生治療は実現できる。
これらの一連の材料、技術、方法論は、「研究」にも役立つ。細胞シートの積層化、細胞凝集体などの3次元細胞培養のための材料、技術、方法論が研究開発されている。体内環境に近い3次元条件で細胞を培養すること、細胞機能の遺伝子改変やオルガノイドの作製などは、細胞研究や創薬研究にも革新をもたらすことになる。これまで、生物医学、薬学と理工学との融合領域で発展してきた研究分野に「バイオテクノロジー」がある。この分野の研究対象は、タンパク質、遺伝子、細菌、ウイルスなどであり、すでに、研究成果からいろいろな商品化が実現してきている。その研究対象に、「細胞」が新たに加わったと考えるのはどうであろうか。これまでに得られている材料、道具、技術を「細胞」に向け、細胞の機能を最大限に利用する(細胞を元気にする)。これこそが再生医療の本質であり、再生医療とは「細胞バイオテクノロジー」と考えられる。
体は、2次元ではなく、3次元構造をもっている。そこで、細胞からなる3次元成形体を創ることが試みられている。3次元細胞成形体を創る1つの方法は、細胞に親和性のある3次元成形体を利用することである。これまでにも望まれていた細胞培養中に変形せず、栄養酸素の供給の優れたゼラチン繊維のみからなる不織布(Genocel™)が開発されている。このゼラチン繊維3次元不織布内で細胞を培養したところ、0.8mmという厚い不織布内でも、細胞は均一に増殖し、不織布内部の細胞は死滅することなく、正常に機能していた。
細胞の3次元成形体を作るもう1つは、細胞自身がお互いを認識する性質を利用する方法であり、"オルガノイド"という言葉で広く知られている。すでに、細胞親和性のよいゼラチンハイドロゲル粒子(GelArt™)を細胞凝集体内に組み込むことで、凝集体内部の栄養、酸素の供給状態が改善され、細胞死を抑制できることが報告されている。細胞シートを用いた3次元成形体の調製にも、細胞シート間にゼラチンハイドロゲル粒子をはさむというシンプルな技術で、細胞機能の高い、厚い3次元細胞成形体の構築が可能となっている。
細胞への栄養の供給のためにはDDSが必要不可欠である。例えば、ゼラチンハイドロゲル(Medgel™、GelArt™)を用いた徐放化技術により、体内で寿命の短い、不安定な細胞増殖因子などを生物活性をもった状態で長期間にわたって細胞に作用させ、細胞の能力を高めることが可能となり、ヒトにおける血管誘導治療、骨、軟骨、脂肪、皮膚真皮、および胸骨と胸骨周辺軟組織の再生治癒促進治療を可能としてきた。この徐放化技術は低分子、核酸医薬、あるいは細胞外分泌小胞(EV)などにも利用可能である。
生体組織の再生修復を期待する部位周辺に細胞が存在しなければ、細胞をその必要部位に呼び寄せることが必要となる。DDS技術の利活用により、幹細胞の体内動員を高め、生体組織の再生修復を促進することも可能となっている。
体外でいかに優れた能力をもつ細胞でも、移植部位の局所環境が整っていなければ、体内ではその生存も機能発現も期待できない。移植細胞の生存、機能を改善する方法として、①細胞に栄養を与える、②細胞に住家(足場)を与える、③細胞に住家(足場)と栄養を与える、④細胞同士の相互作用を高める、および⑤体内での炎症反応を制御するなどの5つが考えられる。臨床応用可能なinjectable足場などの研究開発も進み、いずれの方法もTissue Engineering技術の組み合わせにより達成されている。
一般に、組織、臓器の欠損あるいは障害が生じた場合、修復の有無に関係なく、最初に起こるイベントは炎症である。炎症がなければ生体組織の再生修復は起らない。すなわち、炎症反応の程度と性質が、それに引き続いて起こる再生修復の成績に影響を与える。中でも、炎症反応の方向性を制御している重要な細胞であるマクロファージの動員とその抗炎症性が、組織の再生修復の結果を左右することがわかってきた。Tissue Engineering技術によりマクロファージの動員と抗炎症性の制御し、再生治療を加速する方法論も始まっている。
再生治療には3つの目的がある。第1の目的は、これまでにない治療方法を創り出すことである。2つ目は、からだの自然治癒力を高め、高齢あるいは合併症をもつ患者への従来治療の適用拡大である。3番目は病気の悪化進行の抑制である。病気の初期段階において自然治癒力を高めることで、病気の悪化進行を遅らせることである。第1の目的が期待の大きいところであるが、第2、3の目的も、実臨床では、大切であり、実現性は高いと考えられる。一般には、再生医療=細胞移植というイメージが強いが、その基本概念は元気な細胞を治療あるいは研究へと応用することである。これを実現するためには、細胞だけでなく、細胞の増殖分化能力を高めるために、体内環境に近い細胞の周辺環境を作り与えることができるTissue Engineering技術が必要不可欠となる。この技術が細胞移植と両輪のごとく調和して発展していくことが大切であることは疑いない。
- 参考文献
-
- 田畑泰彦, 自然治癒力を介して病気を治す。体にやさしい医療「再生医療」-細胞を元気づけて病気を治す-. 2014, 大阪: メディカル ドゥ.
- 田畑泰彦 編 細胞の3次元組織化に不可欠な最先端材料技術-再生医療、その支援分野(細胞研究、創薬研究)への応用と発展のために-2014 ㈱メディカル ドゥ
- 田畑泰彦・塙隆夫編著, バイオマテリアル その基礎と先端研究への展開. 2016, 東京: 東京化学同人.
- 田畑泰彦、眼薬理、34、7-19 2020
膵臓の発生分化再生研究
東京工業大学 生命理工学院
粂 昭苑
寄稿日(2023年3月)
- 1.試験管内で膵臓発生分化を摸倣する:多能性幹細胞からの膵臓の分化誘導
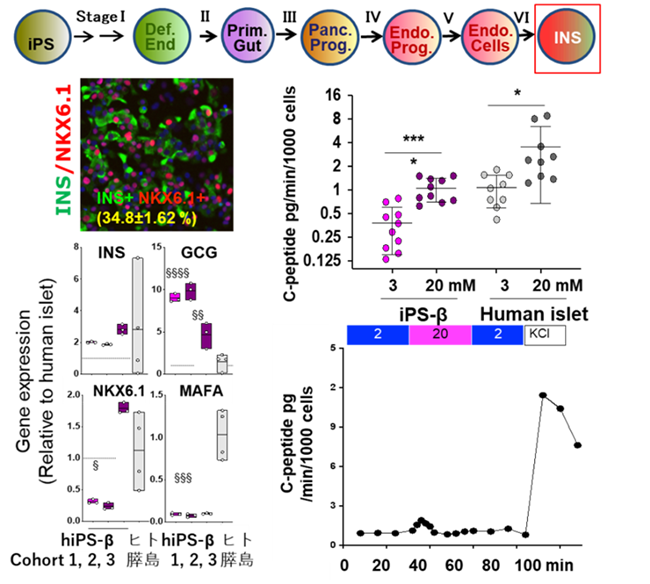
重篤な糖尿病の根治療法として、膵臓移植が適応となっている。移植医療にはドナー不足が大きな問題点として挙げられ、その解決には幹細胞を用いる研究が期待されている。
哺乳類の発生において、膵臓は胚性内胚葉(SOX17陽性)から発生する。膵臓前駆細胞(PDX1陽性)、内分泌前駆細胞(Neurog3陽性)を経てインスリンを産生するβ細胞が分化してくる[1]。膵臓β細胞の発生分化に関わるシグナル分子や転写因子が多く同定されている。試験管内で、発生過程を模倣することでインスリン産生細胞へ分化する手法が飛躍的に進歩した。2014年にヒト多能性幹細胞から成熟膵臓β細胞を作製した論文が報告された[2,3]。これらの報告では、多能性幹細胞(ヒトES細胞、iPS細胞)由来膵臓β細胞を糖尿病マウスへ移植数週後には糖に応答したヒトインスリン分泌が確認されたとしている。これらの方法を基にさらに改良方法がその後相次いで報告された[4–7]。- 2.多能性幹細胞の特殊な代謝状態を利用した分化誘導方法の構築
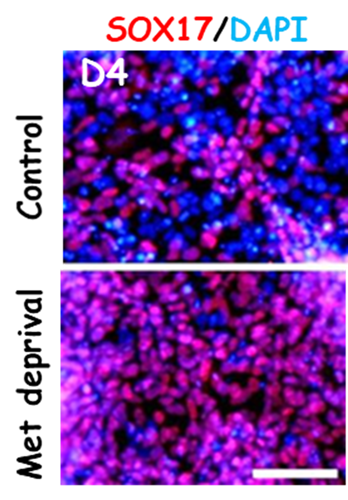
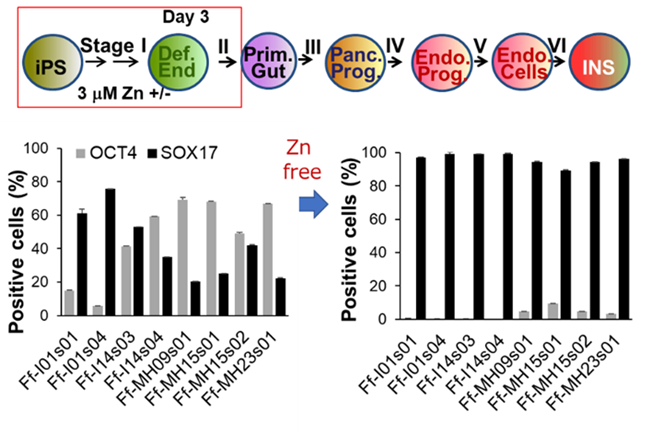
・多能性幹細胞はメチオニンに高く依存した特殊な代謝状態にある
多能性幹細胞は未分化性を維持するためにメチオニンの代謝物であるS-アデノシルメチオニン(SAM)を必要とし、メチオニン欠乏は幹細胞内のSAM減少を引き起こして、分化に適した状態に遷移させる。メチオニン不含培地で長時間(24時間)培養することで多能性幹細胞が死滅する。このことを利用したメチオニン不含培地を開発した。このメチオニン不含培地を利用した培養により、初期分化の促進および分化時に残存する未分化細胞の選択的除去に成功した(図1)。このように、多能性幹細胞の代謝的な特性を利用することにより、細胞株によらず効率的に内胚葉を分化誘導することが容易になった[8]。
・メチオニン代謝の下流シグナルとしての亜鉛シグナルの同定
メチオニン代謝の下流シグナルを明らかにする目的で網羅的遺伝子発現解析を行った結果、メチオニン欠乏により多能性幹細胞において亜鉛排出トランスポーターSLC30A1遺伝子が有意に増加することを見出した。そこで、亜鉛濃度を測定したところ、メチオニン除去培地で5時間培養した場合に、幹細胞内のタンパク質結合型亜鉛が有意に減少した。この亜鉛濃度低下には、メチオニン代謝物であるホモシステインが寄与することもわかった[9]。
次に、味の素(株)との共同で亜鉛除去培地を新たに開発した。この亜鉛除去培地で幹細胞を数日間培養すると、細胞内の亜鉛含量の低下を再現できた。また、亜鉛欠乏培地での培養下では、メチオニン欠乏による内胚葉分化の促進[8]を模倣することを確認した[9](図2)[9]。これらの結果より、メチオニン欠乏は幹細胞内の亜鉛含有量を低下させることにより、細胞分化を促すと結論づけた。
・メチオニン欠乏/亜鉛欠乏培地の利用と汎用性の高い分化誘導方法の構築
そこで、メチオニン欠乏と亜鉛欠乏培地を組み合わせることで、複数の多能性幹細胞を効率的に内胚葉へ分化させることに成功した。汎用性の高い、機能的な膵臓β細胞を分化誘導する新規培養方法を確立した(図3)[9]。得られた多能性幹細胞由来の膵臓β細胞は、INS+/NKX6.1+のダブル陽性細胞の割合が高く(約35%程度)、INSULIN、NKX6.1伝子発現レベルはヒト膵島と同等レベルであり、糖応答性インスリン分泌能は、ヒト膵島にそれほど遜色はない、しかも高グルコースに反応した急峻な第1相インスリン分泌が見られることから、機能の高い膵臓β細胞が作製されたと考えている[9]。- 3.膵臓β細胞の発生分化と機能を制御するドパミンシグナル
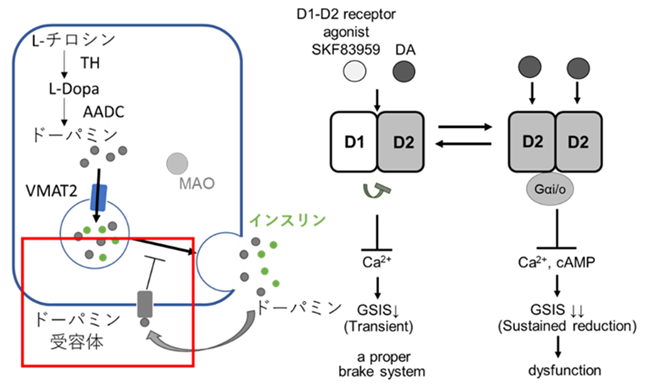
上記のように、ヒトiPS細胞から膵臓β細胞を作製する研究を進めている一方、筆者らの研究室では、膵臓の発生分化機序の解明を目指して、ヒト多能性幹細胞からの膵臓分化誘導系を利用した低分子化合物ライブラリースクリーニングにより、膵臓分化に関わるシグナル因子の探索研究、作用機序解明を行っている。その過程で、神経伝達物質として知られているモノアミンの一種のドパミンは、膵β細胞への分化を抑制するシグナルとして発見し[10,11]、膵臓β細胞からのインスリン分泌のフィードバック抑制機能を持つことで、逆に膵臓β細胞の機能維持に関与していることが分かってきた。
膵臓β細胞において、チロシンをL-DOPAに変換するTyrosine Hydroxylase(TH)、L-DOPAからドパミンへ変換するAromatic and L-amino acid decarboxylase (AADC)を発現している。またドパミンを貯蔵する分泌小胞に取り込む分泌型トランスポーター(VMAT2)、ドパミンを分解するMAOBや、細胞外のドパミンを再取り込みするdopamine transporter(DAT)を発現している[12] (図4)。DATによって取り込まれたドパミンは、Monoamine oxidase B(MAOB)によって分化される際に活性酸素(ROS)を生成する。β細胞特異的にVMAT2欠損したマウスに、高脂肪食を給餌し、代謝負荷をかけた場合、膵臓β細胞がROSに過剰に晒された結果、脱分化することを見出した[13]。
一方、膵臓β細胞からインスリン分泌する際に、ドパミンがインスリンと共に細胞外に分泌される。分泌されたドパミンは、β細胞のドパミン受容体に働き、インスリン分泌を負に制御する。ドパミンは、高グルコース濃度に反応した素早い1相目の後の持続的で緩やかな2相目のインスリン分泌調節に関わっているようである[14]。様々な解析の結果、ドパミンは、D1-D2ヘテロ多量体を介してインスリン分泌抑制効果を示すことが分かった。一方で、D2受容体ホモ多量体の活性化は、脱分化を促進することが分かっている。したがって、インスリン分泌を抑制する機構が急激に進行しないようにD1受容体によるD1-D2ヘテロ多量体形成が一種の“ブレーキ”として一役を担っており、膵臓β細胞の機能維持に寄与している(図4)[14]。
近年2型糖尿病はβ細胞の脱分化によるものと提唱されており、脱分化によりβ細胞が機能を失うと考えられる[15]。一方、β細胞のヘテロ性が提唱されている[16]。膵臓β細胞が積極的にドパミンを利用して、機能抑制や脱分化を起こすことで細胞死によってβ細胞量が低下することを避けていると思われる。今後、ドパミンシグナルによるブレーキの分子機構をさらに理解することで、今後の再生医療の進歩に活かしていきたいと考えている。
- 文献
-
- Sim EZ, Shiraki N, Kume S. Recent progress in pancreatic islet cell therapy. Inflamm Regen 2021;41:1–10.
- Pagliuca FW, Millman JR, Gürtler M, et al. Generation of Functional Human Pancreatic β Cells In Vitro. Cell 2014;159:428–439.
- Rezania A, Bruin JE, Arora P, et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nat Biotechnol 2014;32:1121–1133.
- Veres A, Faust AL, Bushnell HL, et al. Charting cellular identity during human in vitro β-cell differentiation. Nature 2019;569:368–373.
- Velazco-Cruz L, Song J, Maxwell KG, et al. Acquisition of Dynamic Function in Human Stem Cell-Derived β Cells. Stem Cell Reports 2018;6:940–956.
- Nair GG, Liu JS, Russ HA, et al. Recapitulating endocrine cell clustering in culture promotes maturation of human stem-cell-derived β cells. Nat Cell Biol 2019;21:263–274.
- Hogrebe NJ, Augsornworawat P, Maxwell KG, et al. Targeting the cytoskeleton to direct pancreatic differentiation of human pluripotent stem cells. Nat Biotechnol 2020;38:460–470.
- Shiraki N, Shiraki Y, Tsuyama T, et al. Methionine metabolism regulates maintenance and differentiation of human pluripotent stem cells. Cell Metab 2014;19:780–794.
- Sim EZ, Enomoto T, Shiraki N, et al. Methionine metabolism regulates pluripotent stem cell pluripotency and differentiation through zinc mobilization. Cell Rep 2022;40:111120.
- Sakano D, Shiraki N, Kikawa K, et al. VMAT2 identified as a regulator of late-stage β-cell differentiation. Nat Chem Biol 2014;10:141–148.
- Sakano D, Choi S, Kataoka M, et al. Dopamine D2 Receptor-Mediated Regulation of Pancreatic β Cell Mass. Stem Cell Reports 2016;7:95–109.
- Harris PE, Ferrara C, Barba P, et al. VMAT2 gene expression and function as it applies to imaging beta-cell mass. J Mol Med (Berl) 2008;86:5–16.
- Sakano D, Uefune F, Tokuma H, et al. Vmat2 safeguards b-cells against dopamine cytotoxicity under high-fat diet–induced stress. Diabetes 2020;69:2377–2391.
- Uefune F, Aonishi T, Kitaguchi T, et al. Dopamine Negatively Regulates Insulin Secretion Through Activation of D1-D2 Receptor Heteromer. Diabetes 2022;71:1946–1961.
- Talchai C, Xuan S, Lin HV V, et al. Pancreatic β Cell Dedifferentiation as a Mechanism of Diabetic β Cell Failure. Cell 2012;150:1223–1234.
- Bader E, Migliorini A, Gegg M, et al. Identification of proliferative and mature β -cells in the islet of Langerhans by. Nature 2016;535:430–434.
-
図1:メチオニン欠乏への暴露による
内胚葉(SOX17+)細胞への分化促進 -
図2:汎用性の高い分化誘導方法の構築
~亜鉛欠乏培地による内胚葉の分化促進~ -
図3:分化誘導プロトコールの最適化により
機能的iPS-β細胞の作製 -
図4:D1-D2へテロ多量体がβ細胞のドパミン応答に関与する
iPS細胞を用いたT細胞の再生と治療開発
京都大学iPS細胞研究所
金子 新
寄稿日(2023年5月)
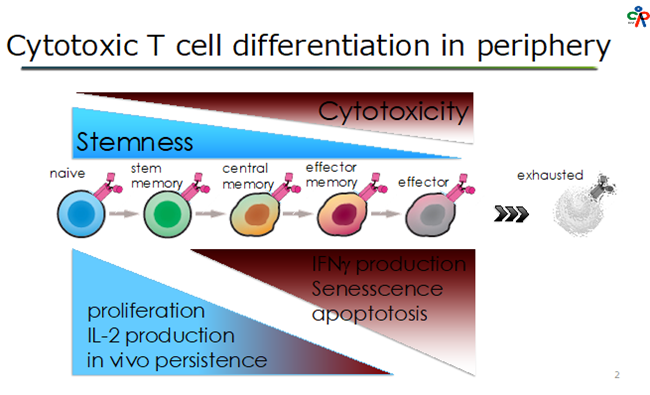
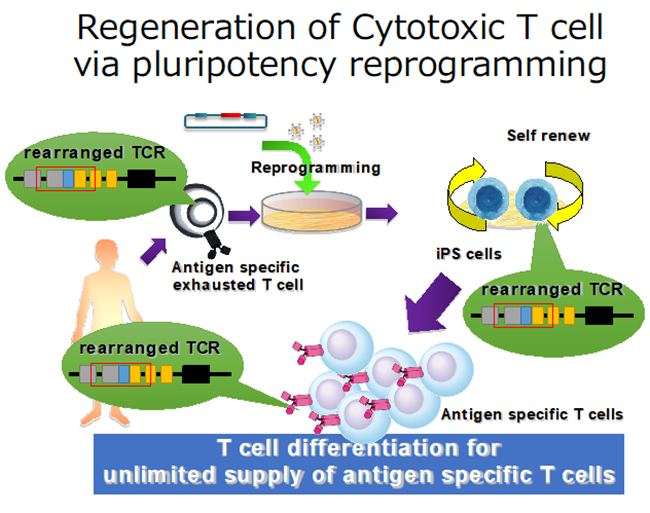
がん治療の一つとして、患者自身の免疫細胞を活用するアプローチが急速に普及している。代表的な例として、免疫反応を負の方向に制御する分子を阻害して抗腫瘍免疫を賦活化する免疫チェックポイント阻害抗体や、患者自身のT細胞にキメラ抗原受容体(CAR)を導入して標的抗原に対する特異的な細胞傷害性を発揮できるように改変したCAR-T細胞1)などが、いくつかの腫瘍に対して著しい効果を示している。中でもCAR-T細胞は「活きた」製剤であるがゆえの扱い難さ、すなわち最終製品を滅菌できないことや原料すなわち患者自身のT細胞を都度用いることに起因する製造の不安定性などが、品質管理の難しさを増している。そしてそれは治療の供給や普及にとっての大きな問題となっている。近年、患者自身のT細胞をもちいた個別製造・品質管理の困難さを解消する手段として、複数患者の治療に用いることのできる健常人由来のCAR-T細胞の開発が進んでいる2)。それらのT細胞は同種免疫原性の強いHLA分子を発現しないように編集されたり、T細胞抑制抗体の標的となる分子を発現しないように編集されたりしており、同種免疫反応で完全に排除されない工夫が施されている。健常人由来のT細胞はTCR刺激により比較的良く増殖して、複数患者治療のためのCAR-T細胞を製造できることから、患者自身の自家CAR-T細胞治療に変わる同種CAR-T細胞治療に期待が集まっている。
我々の研究室では、同種CAR-T細胞のソースをiPS細胞とすることによって、より安定した製造管理、品質管理のもとに製品を広く早く供給することができると考え、その開発を続けている。iPS細胞は無限の増殖能と体を構成するすべての細胞に分化する能力を兼ね備えている多能性幹細胞の一つである。2007年のヒトiPS細胞樹立の最初の報告の後、現在までにiPS細胞をソースとする幾つかの臨床試験が国内外で開始されるに至った。iPS細胞を介したT細胞再生は2013年に最初に報告された3,4,5)。当初は分化誘導プロトコールの不完全さ、特に胸腺内に存在する分化途中のT細胞の表現型を持つCD4/CD8両陽性T細胞(DP)からCD8キラーT細胞を誘導する際の刺激手法の不完全さのため、抗原特異的T細胞受容体(TCR)を介した細胞傷害性に加えてNK細胞様のTCR非依存性細胞傷害性を有する特殊なCD8T細胞が誘導されていた。しかし、その後の様々な改良を経て、現在は強力な同種CAR-T細胞ソースとして名乗りを上げつつある。
当初の報告以降に、我々を含む国内外の研究者等によってなされた主な改良点を列挙し、要約する。・iPS細胞からの分化誘導の適正化によって、よりT細胞らしさを増したCD8キラーT細胞を再生6):DPへの強力なTCR刺激は同細胞の細胞死を誘導し、正常なCD8キラーT細胞への分化を阻害していた。デキサメサゾンと抗CD3抗体、IL-7を組み合わせることによりDPの細胞死を抑制しつつCD8キラーT細胞を分化誘導することが可能となった。また、T細胞分化の過程で活性化する内在性のTCR組み換え遺伝子をノックアウトすることで、抗原特異的TCR配列が維持されることが明らかになった。
・CD8キラーT細胞への分化刺激をさらに適正化することによる、セントラルメモリーCD8キラーT細胞の再生7):DPへのTCR刺激時にファイブロネクチンとIL-7、IL-21を併用することにより少数のDPからでもnaivenessの高いメモリーCD8T細胞を誘導することが可能となった。それらのCD8T細胞は増殖しつつ連続的に標的細胞を傷害するserial killingの活性に優れたT細胞であった。
・iPS細胞を介した腫瘍浸潤CD8Tリンパ球(CD8TIL)からのCD8キラーT細胞再生8):ヒト大腸がんより分離したポリクローナルCD8TILをiPS細胞を介して再生し、もとのCD8TILに比して細胞一つあたりの様々な機能が良質のメモリー細胞に近くなる“若返り”を示したポリクローナルCD8キラーT細胞集団を得られることが明らかになった。
・臨床用HLAホモiPS細胞ストックを任意のT細胞受容体(TCR)で改変したTCR-iPS細胞からのT細胞誘導6):T細胞から作られたiPS細胞からの分化誘導のみならず、臨床用のHLAホモiPS細胞ストックに任意のTCRを遺伝子導入することによって、抗原特異的T細胞を誘導できることが明らかになった。
・CAR遺伝子導入iPS細胞由来のT細胞の機能強化を目的とした免疫シグナル増強法の開発9):CAR遺伝子を導入し免疫チェックポイント分子DGKをノックアウトしたiPS細胞から誘導したT細胞に膜結合型IL-15/IL-15Ra複合体遺伝子を導入し、T細胞機能に重要な2種のシグナルを増強した高機能型iCAR-T細胞を開発した。高機能型iCAR-T細胞は皮下移植固形腫瘍モデルにおいて、末梢血CAR−Tを上回る生存期間の延長を示した。
・iPS細胞におけるHLA編集やNK細胞受容体リガンド編集によるiPS-T細胞の低免疫原性化10):iPS細胞に4種の遺伝子改変を加えることにより、CD4T細胞、CD8T細胞、NK細胞の認識をかいくぐるステルスiCAR-T細胞を作成した。同細胞はヒト末梢血移植マウスモデルにおいて同種免疫の影響を受けにくく、腫瘍制御に優れることが明らかになった。
・臨床製造に適した原材料と分化誘導プロトコールを用いたCAR-iPS-T細胞の誘導11):フィーダー細胞や異種成分を用いずにiCAR-T細胞を誘導するプロトコールを確立した。同プロトコールによるiCAR-T細胞は健常人由来CAR-T細胞と同等の白血病マウス治療効果を示した。
・人工胸腺オルガノイドを用いたiPS細胞由来CD8、CD4T細胞の再生12):T細胞分化に必要なNotchシグナルのリガンドを発現したマウスフィーダー細胞とiPS細胞由来造血内皮細胞の3D共培養によって、より生理的な分化を経たT細胞が得られることが明らかになった。
この他にも様々な研究開発がアカデミアや民間企業を問わず実施されており、iPS細胞由来の免疫細胞実用化への期待は益々高まっている。
- 文献
-
- June, C.H. and M. Sadelain, Chimeric Antigen Receptor Therapy. N Engl J Med, 2018. 379(1): p. 64-73.
- Kamal-Bahl, S., et al., Barriers and solutions to improve access for chimeric antigen receptor therapies. Immunotherapy, 2022.
- Nishimura, T., et al., Generation of rejuvenated antigen-specific T cells by reprogramming to pluripotency and redifferentiation. Cell Stem Cell, 2013. 12(1): p. 114-26.
- Themeli, M., et al., Generation of tumor-targeted human T lymphocytes from induced pluripotent stem cells for cancer therapy. Nat Biotechnol, 2013. 31(10): p. 928-33.
- Vizcardo, R., et al., Regeneration of human tumor antigen-specific T cells from iPSCs derived from mature CD8(+) T cells. Cell Stem Cell, 2013. 12(1): p. 31-6.
- Minagawa, A., et al., Enhancing T Cell Receptor Stability in Rejuvenated iPSC-Derived T Cells Improves Their Use in Cancer Immunotherapy. Cell Stem Cell, 2018. 23(6): p. 850-858 e4.
- Kawai, Y., et al., Generation of highly proliferative, rejuvenated cytotoxic T cell clones through pluripotency reprogramming for adoptive immunotherapy. Mol Ther, 2021. 29(10): p. 3027-3041.
- Ito, T., et al., The therapeutic potential of multiclonal tumoricidal T cells derived from tumor infiltrating lymphocyte-1derived iPS cells. Commun Biol, 2021. 4(1): p. 694.
- Ueda T et al., Optimization of the proliferation and persistency of CAR T cells derived from human induced pluripotent stem cells. Nat Biomed Eng. 2023 Jan;7(1):24-37.
- Wang, B., et al., Generation of hypoimmunogenic T cells from genetically engineered allogeneic human induced pluripotent stem cells. Nat Biomed Eng, 2021. 5(5): p. 429-440.
- Iriguchi, S., et al., A clinically applicable and scalable method to regenerate T-cells from iPSCs for off-the-shelf T-cell immunotherapy. Nat Commun, 2021. 12(1): p. 430.
- Montel-Hagen, A., et al., Organoid-Induced Differentiation of Conventional T Cells from Human Pluripotent Stem Cells. Cell Stem Cell, 2019. 24(3): p. 376-389 e8.
ゲノム編集を活用した遺伝子変異修復、免疫拒絶回避、生体内送達 new!
京都大学 iPS細胞研究所 臨床応用研究部門
堀田 秋津
寄稿日(2024年3月)
- はじめに
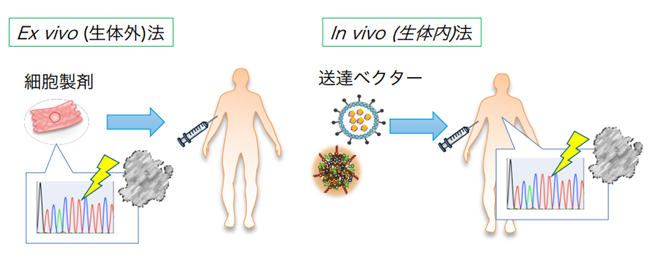
ゲノム編集技術とは、CRISPR-Cas9など特定の塩基配列を認識して切断するヌクレアーゼを用い、標的DNA配列部位に生細胞内でDNA修復機構を誘導し、塩基配列を改変する手法である。その簡便さと高い変異導入効率、そしてヒトゲノム上のほぼ全ての遺伝子を標的とできる汎用性から、もはや無くてはならない研究ツールとなっている。最近では、Ex vivo(生体外)でゲノム編集された細胞を用いた細胞治療や、ゲノム編集酵素を直接患者に投与してin vivo(生体内)で疾患の原因となる遺伝子変異を修復する遺伝子治療法などの臨床応用も始まりつつある(図1)。前者については、造血幹細胞やCAR-T細胞のように細胞移植治療が確立している製剤がベースとなり、臨床応用も先行している。実際、成人型(β)ヘモグロビン遺伝子変異が原因の鎌状赤血球貧血患者の造血幹細胞を体外に取り出して、CRISPR-Cas9を用いてBCL11Aという転写抑制因子のエンハンサーをゲノム編集で除去することにより、胎児型(γ)ヘモグロビン遺伝子の発現を活性化させてから細胞を戻すCASGEVYが、2023年11月に英国で、そして12月に米国FDAで承認された。ついに、”ゲノム編集治療”の時代が幕を開けたのだ。また、In vivo法についても、肝臓や網膜、そして腫瘍を標的とした臨床試験が複数進行中である。このように、ゲノム編集はアイデア次第で多様な応用が可能であり、本稿では一例として我々の開発してきた技術を紹介したい。
- 多様なCRISPRシステムを用いた疾患変異修復
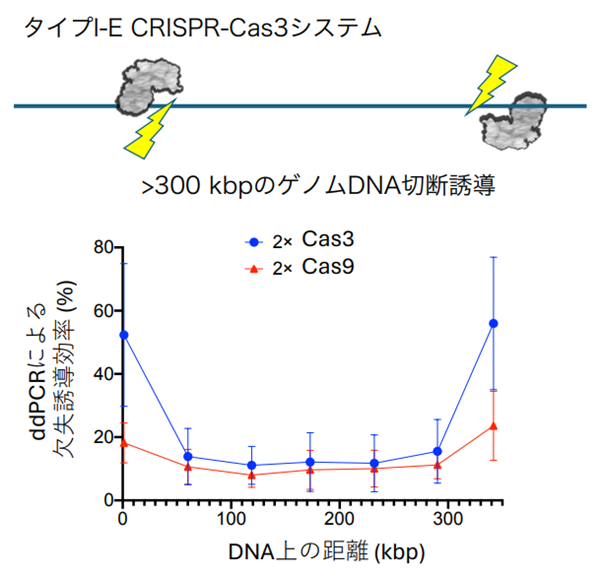
2012年にCRISPR-Cas9がgRNA(ガイドRNA)の配列依存的にDNAを切断することを発見されて以来、治療応用に向けて様々な改良が加えられてきた1。DNAとの結合親和性を制御することで配列認識特異性を高めたり、Cas9タンパク質が認識するPAM配列(例えばNGG)の制約を拡張してより広い配列を標的とできるようにしたり、様々なドメインを付与して機能を拡張したりする方法が報告されている。付与するドメインとしては、デアミナーゼドメインを融合することで一塩基だけ改変可能なBase editorや、逆転写酵素を付与してgRNAに付与した鋳型配列をDNA化することで、任意の配列を書き換えたり挿入したりすることが可能なPrime editor、あるいはエピゲノム修飾酵素(DNAメチル化酵素、脱メチル化酵素、ヒストン修飾酵素)を付与したエピゲノム編集などへの応用が広がっている。
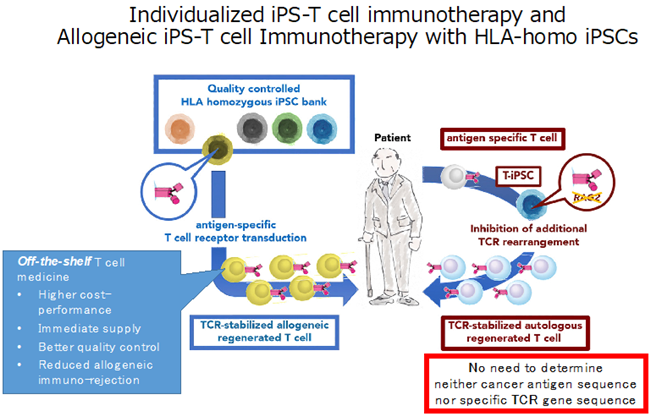
また、最初に発見された化膿性レンサ球菌由来のCRISPR-Cas9だけに留まらず、自然界に存在する多様なCRISPRシステムがヒトゲノムの編集に応用されている。我々は長鎖欠失を誘導するという特徴を持つ大腸菌由来のタイプI-E CRISPR-Cas3システム2を応用することで、数百kbを超えるゲノム欠失を誘導可能であることを報告した(図2)3。これにより、多様な変異パターンを持つデュシェンヌ型筋ジストロフィー患者のおよそ6割をカバー可能な変異修復方法になると期待される。このように、CRISPRの種類ごとに認識PAM配列や特異性、誘導するDNA切断パターンに違いがあり、知財ライセンスの使いやすさも含め、目的に応じて使い分けが進むと思われる。- 同種(他家)免疫拒絶回避への応用
先に述べたように、ゲノム編集技術はすでに細胞移植治療への応用が始まっているが、細胞移植において自家細胞を用いると一製剤で患者一名しか治療ができず、製剤製造が煩雑になる上に、患者ドナーの状態によって採取する細胞の品質が担保できないといった課題がある。これらの点は健常ドナー由来の品質を確認できた細胞を予め既製品化(off-the-shelf)しておくことで解決できるが、同種(他家)移植となるため免疫拒絶が誘導されてしまう。我々は他家免疫拒絶に最も大きく関わっているHLA遺伝子群の内、HLA-AとHLA-B遺伝子、そしてHLAクラスIIの転写に必要なCIITA遺伝子をゲノム編集でノックアウトすることで、HLAミスマッチに起因する同種免疫応答を回避する手法を開発した4。比較的多様性の少ないHLA-CやHLA-Eを残存させることで、T細胞だけでなくNK細胞からの攻撃も回避できる点がポイントであり、すでに臨床グレードのHLA編集iPS細胞が製造され5、iPS細胞ストックとして公益財団法人京都大学iPS細胞研究財団より安価で提供しているので、是非活用頂きたい。
- 生体内ゲノム編集治療への応用
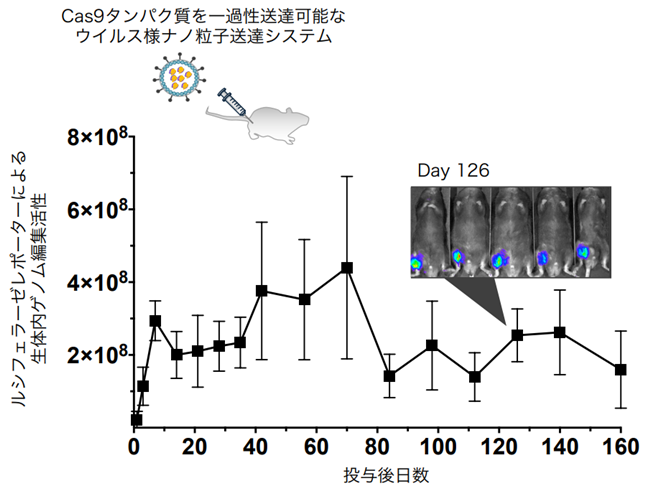
再生医療において細胞移植は王道のアプローチであるが、一般的には細胞が損傷等で失われた後に移植するケースが多い。しかしそれでは火災が発生してから必死に消火や再建しようとするに等しく、理想的には失火を予防することが望ましい。先天的な遺伝子変異が原因で細胞等が失われている場合には、原因となる遺伝子変異を修復する遺伝子治療アプローチが重要となる。古典的な遺伝子治療では、変異遺伝子の代わりに機能性遺伝子を外部から補填していたが、この場合は外来遺伝子を長期に渡り発現を継続することが治療効果の維持に必須のため、細胞内に長期に留まるウイルス・ベクターが多用されてきた。一方で、ゲノム編集酵素を生体内に送り届ける場合、DNAの切断活性はごく短期間だけで十分で、ゲノム編集された細胞が生存する限りは治療効果が継続することが期待される。我々はレンチウイルスベクターと細胞外小胞の長所を併せ持つウイルス様粒子を開発し、CRISPR-Cas9タンパク質を搭載して一過性にマウスモデルに送達できることを示した(図3)6。また、COVID-19に対するワクチンとして脚光を集めた脂質ナノ粒子(LNP)にCas9 mRNAとgRNAを搭載することで、こちらも一過性に送達できることを示した7。一方、マウスでのゲノム編集効果は一年以上に渡り観察することができ、長期に渡って維持可能であることが示唆された。我々のグループ以外にも、ゲノム編集分野の研究者達がこぞって新規の送達技術開発に乗り出しており8 9、今後も更に新しい送達技術が出てくることが予想される。
- おわりに
ゲノム編集技術の医療応用も今後、益々進むと思われる。Ex vivo治療法については、上記の免疫拒絶の問題に加えて、細胞の生着や生存能力が低かったり、治療効果そのものが限定的であったりと言った問題が山積しており、ゲノム編集技術で細胞へ機能を付与することで改善が進むと期待される。また、In vivo治療法を実現させるためには、効率的かつ安全な送達技術が鍵となる。日本発の斬新な新技術が開発され、より多くの疾患に対する革新的な治療法が出てくることを願っている。
- 文献
-
- Doudna, J. A. The promise and challenge of therapeutic genome editing. Nature 578, 229-236, doi:10.1038/s41586-020-1978-5 (2020).
- Morisaka, H. et al. CRISPR-Cas3 induces broad and unidirectional genome editing in human cells. Nat Commun 10, 5302, doi:10.1038/s41467-019-13226-x (2019).
- Kita, Y. et al. Dual CRISPR-Cas3 system for inducing multi-exon skipping in DMD patient-derived iPSCs. Stem Cell Reports 18, 1753-1765, doi:10.1016/j.stemcr.2023.07.007 (2023).
- Xu, H. et al. Targeted Disruption of HLA Genes via CRISPR-Cas9 Generates iPSCs with Enhanced Immune Compatibility. Cell Stem Cell 24, 566-578 e567, doi:10.1016/j.stem.2019.02.005 (2019).
- Kitano, Y. et al. Generation of hypoimmunogenic induced pluripotent stem cells by CRISPR-Cas9 system and detailed evaluation for clinical application. Mol Ther Methods Clin Dev 26, 15-25, doi:10.1016/j.omtm.2022.05.010 (2022).
- Gee, P. et al. Extracellular nanovesicles for packaging of CRISPR-Cas9 protein and sgRNA to induce therapeutic exon skipping. Nat Commun 11, 1334, doi:10.1038/s41467-020-14957-y (2020).
- Kenjo, E. et al. Low immunogenicity of LNP allows repeated administrations of CRISPR-Cas9 mRNA into skeletal muscle in mice. Nat Commun 12, 7101, doi:10.1038/s41467-021-26714-w (2021).
- Raguram, A., Banskota, S. & Liu, D. R. Therapeutic in vivo delivery of gene editing agents. Cell 185, 2806-2827, doi:10.1016/j.cell.2022.03.045 (2022).
- Madigan, V., Zhang, F. & Dahlman, J. E. Drug delivery systems for CRISPR-based genome editors. Nat Rev Drug Discov 22, 875-894, doi:10.1038/s41573-023-00762-x (2023).