はじめに
皆さんが実際に基礎・臨床研究あるいは再生医療の提供を始める際には、実施する内容に関連する規制について、詳細に内容を確認していただく必要があります。ここで、規制になじみのない方は、それに関する知識の収集をどうやって進めればよいか、途方にくれるかもしれません(つい何年か前の私がそうであったように)。私は、まずは原典、すなわち、法や政省令そのものに尻込みせずに当たることと、厚生労働省や文部科学省関連のHPに掲載された解説に目を通すことが、時間的にも効率的で、正確な情報を理解しやすいと考えています。そこで、このサイトでは、それらのURLのうちとくに重要なものを示しています。
研究・開発を実施するにあたっては規制の順守が必須であることは言うまでもありませんが、これから行う研究・開発を構想する段階でも、規制の全体像をあらかじめ掴んでおいて、それへの対応を意識しながら進めることはとても重要だと思います。本サイトがその一助になれば幸いです。
基礎研究に関する規制
-
ヘルシンキ宣言
http://dl.med.or.jp/dl-med/wma/helsinki2013j.pdf世界医師会で採択された宣言で、人間を対象とする医学研究の倫理的原則を示したものです。この宣言が直接具体的な手続き等を規定するものでありませんが、多くの規制はこのヘルシンキ宣言をその考え方の基盤としているので、一度は全文を読んでおくべきものです。短時間で読めます。
-
「人を対象とする医学系研究に関する倫理指針」
http://www.lifescience.mext.go.jp/bioethics/ekigaku.html患者さんや健常者から細胞を採取し、培養したり、そこからiPS細胞などを作製したりする場合には、必ずこの指針に従わなければなりません。この指針は、①研究機関の長及び研究責任者等の責務に関する規定、②いわゆるバンク・アーカイブに関する規定、③研究に関する登録・公表に関する規定、④倫理審査委員会の機能強化と審査の透明性確保に関する規定、⑤インフォームド・コンセント等に関する規定、⑥個人情報等に関する規定、⑦利益相反の管理に関する規定、⑧研究に関する試料・情報等の保管に関する規定、⑨モニタリング・監査に関する規定、を含みます。
この指針にそった研究計画書を作成し、研究機関が設置する倫理委員会による審査・承認をうけなければなりません。 -
「ヒトゲノム・遺伝子解析研究に関する倫理指針」
http://www.lifescience.mext.go.jp/bioethics/hito_genom.html細胞や組織の提供者やその血縁者の遺伝的素因が研究によって明らかになる場合、その取扱いによっては、様々な倫理的、法的又は社会的問題を招く可能性があります。そのような研究を行う際に適用されるのがこの指針です。次世代シーケンサ等を用いて網羅的遺伝子解析を行う場合にはこの指針に従わなければなりません。この指針には、遺伝情報の開示についてや、健常と思われた提供者の遺伝子解析を行ったところ重篤な疾患に関与する遺伝子異常が偶然発見され場合の対応方法などが示されています。また、提供された貴重な試料やそこから得られたデータ等がより有効に広く活用されるためにはバンク化は重要ですが、この指針ではバンクへの提供の同意に関しても言及しています。また、この指針は後述する「個人情報保護に関する法律」と密接な関係があります。
-
「個人情報の保護に関する法律」(個人情報保護法)
http://elaws.e-gov.go.jp/search/elawsSearch/elaws_search/lsg0500/detail?lawId=415AC0000000057先に述べた「人を対象とする医学系研究に関する倫理指針」と「ヒトゲノム・遺伝子解析研究に関する倫理指針」の中でこの法に則した具体的手続きが定められており、それらと別にこの法への対応のために何らかの書類作成や審査が必要なわけではありませんが、このような法律があるということと、そのポイントは知っておいた方がよいと思われます。
“個人情報”とは何かというと、氏名や生年月日や住所、電話番号など、いわゆる「名簿」に書かれている内容というイメージがまず頭に思い浮かびます。これらの「特定の個人を識別できる」情報への対応として、「匿名化」は実際の情報処理として重要であるのみならず、従来、その語は個人情報の保護ということとほぼ同義であるというイメージでした。しかし、随分以前から、特定の個人を識別できるのは名前や住所だけではないという状況は発生していました。パスポート番号や運転免許証番号、住民票コード、基礎年金番号、保険証番号マイナンバー、クレジットカード番号のような個人に割り当てられた文字、番号、記号が名前や住所と同等かあるいはそれ以上に守るべき情報ですし、指紋データや顔認識データ、虹彩、声紋、そしてDNAのような個人の身体的特徴を変換した文字、番号、記号などやなどもこれに当たります。そこで、平成29年に改正された個人情報保護法では、これらを「個人識別符号」とよび“個人情報”の定義に加えました。ところで、「個人情報保護法」という語は多くの読者が耳にしたことがあると思われますが、この法は非常に複雑であることはあまり知られていません。詳細はここでは述べられませんが、例えば、個人情報保護法(民間事業者に適用)と行政機関個人情報保護法、独立行政法人等個人情報保護法という3つの法律があって適用される実施主体が異なります。研究に関する倫理指針は、研究実施主体によらず、3つの法の適用範囲を跨いですべての研究者が遵守すべきものとして定められています。 -
「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」(カルタヘナ法)
http://www.lifescience.mext.go.jp/bioethics/kankeihourei.html様々な研究において、細胞の遺伝子操作を行うことがあります。ウイルスベクターを用いる場合や、大腸菌を宿主としてプラスミド(ウイルス/非ウイルス)を増幅する場合には、この法律が適用されます。この法律の目的は「生物の多様性の確保を図ること」です(研究を実施する者の安全性を確保するための法律だと思って読むと、理解が難しい点がでてきます)。研究室で遺伝子組換え生物等を扱う場合は、この法における「第二種使用等」にあたり、適切な拡散防止措置を執ることが求められます。 具体的な拡散防止措置については、「研究開発等に係る遺伝子組換え生物等の第二種使用等に当たって執るべき拡散防止措置等を定める省令(平成16年文部科学・環境省令第1号)」および、「研究開発段階における遺伝子組換え生物等の第ニ種使用等の手引き」を参照します。
なお、これに違反した場合には、罰則規定があります。初めて遺伝子組み換え生物等を用いる実験を実施する研究室は勿論の事、既に実施している研究室においても、責任者はその内容を詳細に確認し、少なくとも実施している実験に関連する内容については、全てのメンバーに周知徹底しなければなりません。
臨床に関する規制
-
再生医療に関する規制の枠組み
再生医療の臨床試験(臨床研究または治験)と実診療(治療)を行うには必ず、「再生医療等の安全性の確保等に関する法律(再生医療等安全性確保法)」か、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(医薬品医療機器等法/薬機法)」かのいずれかに従い、適切な手続きを経て行わなければなりません。医師の裁量権を根拠としたいわゆる「自由診療」の形で行うことは決して許されません。
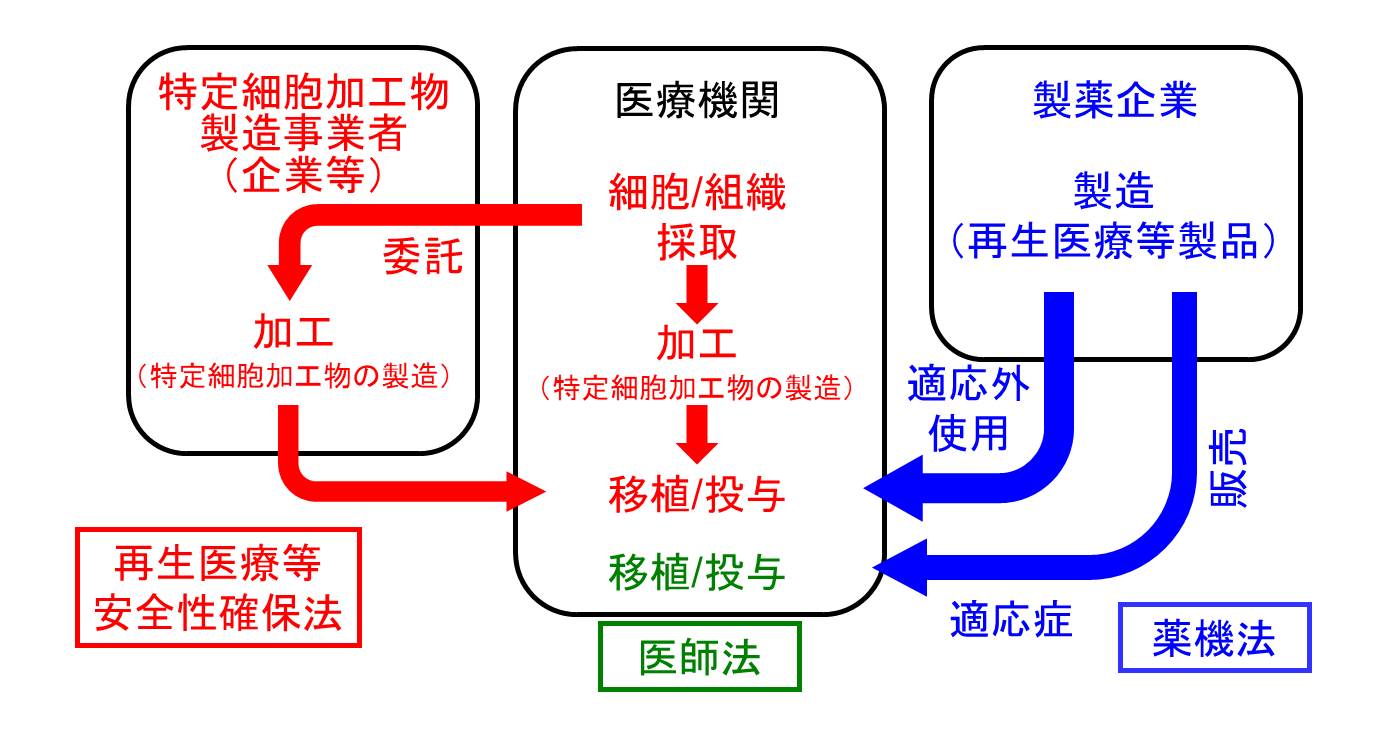
再生医療に関する現行規制の枠組み
再生医療等安全性確保法、医師法、薬機法の規制をうける部分をそれぞれ赤、緑、青で示しました。 -
再生医療等安全性確保法
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/iryou/saisei_iryou/この法律の趣旨は、「再生医療等の迅速かつ安全な提供等を図るため、再生医療等を提供しようとする者が講ずべき措置を明らかにするとともに、特定細胞加工物の製造の許可等の制度等を定める」ことです。 この法のポイントはいくつかあります。
一つは、自由診療による再生医療を許さずこの法で規制することで不適切な“再生医療“が行われるのを防ぎ、全ての再生医療の実態把握を可能にしたという事です。再生医療の臨床研究と、薬機法で製造販売承認を受けた再生医療等製品をその適応症に対して行う場合以外で再生医療を治療として提供する場合が対象になります。
二つ目のポイントは、「特定細胞加工物の製造」を医療機関が企業等に委託することも可能とする点です。かつては再生医療といえば、患者もしくは健常ドナーから採取した細胞を一定期間培養して増殖させるなど、比較的シンプルな工程のみを含むものがほとんどでした。しかし、例えば近年になって想定されるようになったiPS細胞を用いる再生医療では、細胞の採取・初代培養・初期化因子導入・iPS細胞樹立・iPS細胞の拡大培養・凍結・保管・融解・分化誘導・純化・など、非常に多くの工程を含む複雑なものです。この工程内および最終段階で様々な品質管理のための試験も必要となります。かつては医療機関内の一角に培養施設を設け、医療従事者本人あるいは少数の専任スタッフのみで可能であるというイメージであった細胞加工ですが、今日では医療機関外へ委託しなければ到底成立し得ない大がかりな作業となるものが想定されてきました。なお、この製造委託には費用が発生しますが、これは薬機法における「薬価」が「モノの値段」であるのに対し、これはあくまで細胞加工という「業務に対する報酬」です。この仕組みが再生医療分野への産業界の参画を活性化し再生医療発展を加速することも、この法律がつくられた意図の中の重要な一つです。
また、この法律では再生医療等について、人の生命及び健康に与える影響の程度に応じて「第1種再生医療等」「第2種再生医療等」「第3種再生医療等」に3分類して、それぞれ必要な手続を定めています。法やそれに関連する省令(再生医療等の安全性の確保等に関する法律施行規則)に従って作成した提供計画を、第1種と第2種では特定認定再生医療等委員会で、第3種では認定再生医療等委員会に申請し審査をうけ承認される必要があります。
なお、後述する薬機法のもと製造販売承認を受けた再生医療等製品を適応症に対して投与する場合は通常の医薬品と同様に医師法の規制をうけるのみですが、再生医療等製品であっても適応外の疾患に対して臨床研究あるいは治療として投与を行う場合にはこの再生医療等安全性確保法の対象となります。 -
医薬品医療機器等法
http://elaws.e-gov.go.jp/search/elawsSearch/elaws_search/lsg0500/detail?lawId=335AC0000000145かつて薬事法には、医薬品と医療機器という二つのカテゴリーが存在していました。両者は様々な面で大きな違いがあるために、共通の規制を当てはめることには大きな無理があるからです。たとえば、医薬品の治験では二重盲検比較試験は一般的ですが、消化管内視鏡という医療機器で二重盲検比較試験を行おうとすることは全くナンセンスです。臨床試験だけでなく、品質確保についても様々な違いがあります。再生医療に用いる製品は、医薬品、医療機器のいずれとも異なる面があることから、合理的な規制を行うために第3のカテゴリーとして「再生医療等製品」が設けられました。同時に、法の名称が薬事法から薬機法に変わりました。この法に則った臨床試験(「治験」とよび、再生医療等安全性確保法や臨床研究法に基づく「臨床研究」とは区別されます)を経て製造販売承認をうけた製品は保険収載され、「薬価」がつきます。
薬機法に関連する諸規制の内容について解説することは初学者を念頭においた本サイトの企図にそぐわないのでいませんが、将来、再生医療等製品の開発を目指す意思のある読者にとって、薬機法の基本的考え方についての理解や自身が今後取り組むべき課題の認識に役立つと思われる指針等を以下に挙げておきます。
「ヒト(自己)体性幹細胞/(同種)体性幹細胞/(自己)iPS(様)細胞/(同種)iPS(様)細胞/ES細胞 加工医薬品等の品質及び安全性の確保に関する指針」
http://www.nihs.go.jp/cbtp/sispsc/pdf/auto_soma.pdf
http://www.nihs.go.jp/cbtp/sispsc/pdf/allo_soma.pdf
http://www.nihs.go.jp/cbtp/sispsc/pdf/auto_ips.pdf
http://www.nihs.go.jp/cbtp/sispsc/pdf/allo_ips.pdf
http://www.nihs.go.jp/cbtp/sispsc/pdf/hES.pdf指針策定にかかる研究班のリーダーが早川堯夫教授であったことから「早川5指針」とも呼ばれる。冒頭1ページあまりの「はじめに」だけでも是非目を通していただきたい。
「再生医療等製品の製造管理及び品質管理の基準に関する省令」(GCTP省令)
https://www.mhlw.go.jp/seisakunitsuite/bunya/kenkou_iryou/iyakuhin/dl/140825_6-9.pdf#search=%27GCTP%E7%9C%81%E4%BB%A4%27医薬品におけるGMP省令に相当するものです。製造所における製造管理及び品質管理の基準が示されています。
「生物由来原料基準」
https://www.pmda.go.jp/files/000223393.pdfドナーの適格性や適切なウイルス試験の設定、トレーサビリティーの確保によって安全性を確保しようというものです。細胞培養に用いる培地や様々な試薬はこの基準に適合する必要があり、このことに苦労することも多いです。
よくある質問
-
Q1:iPS細胞を使用するには、どのようなレベルの拡散防止措置を執った実験室が必要ですか?
A1:iPS細胞は遺伝子組換え生物ではありませんので、培養や分化誘導を行うにあたって拡散防止措置は不要です。ただし、ウイルスベクターを使って初期化因子を導入する方法でiPS細胞を樹立する場合や、ウイルスベクターを使ってiPS細胞に遺伝子導入する実験を行う場合にはP2実験となります。また、ウイルスベクター/非ウイルスベクターのいずれであっても、プラスミドを大腸菌に導入して増やす際はP1実験となります。
-
Q2:iPS細胞を基礎的研究(臨床研究以外の研究)で用いるには、倫理委員会の承認を得ることが必須ですか?
A2:必ずしも必須ではありません。本サイトの筆者は以下のように考えています。但し、各々の研究機関が設置している倫理委員会ごとに考え方が異なる可能性がありますので、実際に実施する場合には所属する機関の倫理委員会に確認することをお勧めします。
【倫理委員会の承認を受けて実施するべき研究】
-
(1)研究協力者(患者/健常人)からの組織/細胞採取を伴う研究
【例】ヒト疾患特異的 iPS 細胞の作成とそれを用いた疾患解析に関する研究 -
(2)他の機関ですでに採取されていた組織・細胞等の試料提供を受け、これを原料として iPS 細胞を樹立・解析する研究で、提供元研究機関より試料使用機関における倫理委員会での承認が提供機関より求められている試料を用いる研究
【例】理研 BRC から提供される研究用ヒト臍帯血を使用する iPS 細胞研究 -
(3)他の機関で樹立された iPS 細胞を用いて実施する研究で、iPS 細胞の使用機関における倫理委員会での承認が提供機関より求められているものを用いる研究
【例】理研 BRC の疾患特異的 iPS 細胞バンクからの iPS 細胞提供を受けて実施する研究 -
(4)「ヒト iPS 細胞又はヒト組織幹細胞からの生殖細胞の作成を行う研究に関する指針」(文部科学省告示第八十八号)の対象となる研究
【例】ヒト iPS 細胞からの生殖細胞分化誘導研究
【倫理委員会の承認を受けずに実施することができる研究】
-
(1)他の機関で採取された組織・細胞等の試料を原料として iPS 細胞を樹立・解析する研究で、提供元より試料使用機関における倫理委員会での承認が提供機関より求められていない試料を用いる研究
【例】購入したヒト線維芽細胞からの iPS 細胞樹立研究 -
(2)他の機関で樹立された iPS 細胞を用いて実施する研究で、iPS 細胞の使用機関における倫理委員会での承認が提供機関より求められていないものを用いる研究
【例】理研 BRC より、健常者由来 iPS 細胞である 201B7 株や 253G1 株等の提供を受けて実施する研究
-
(1)研究協力者(患者/健常人)からの組織/細胞採取を伴う研究
